Siirry esitykseen
HE 49/2021
Hallituksen esitys eduskunnalle laiksi geenitekniikkalain muuttamisesta
Esityksessä ehdotetaan muutettavaksi geenitekniikkalakia EU:n yleisen elintarvikeasetuksen uudistuksen johdosta. Muuntogeenisillä organismeilla tehtäviä kenttäkokeita sekä mainittuja organismeja sisältävien tuotteiden markkinointia varten toimitettavissa hakemuksissa annettavien tietojen toimittamista koskevia vaatimuksia muutettaisiin. Lisäksi tietojen luottamuksellisuuden merkitsemistä ja vahvistamista koskevia säännöksiä muutettaisiin siten, että geenitekniikan lautakunta voisi vahvistaa salassapidon tiedoille, jotka voivat vahingoittaa toiminnanharjoittajan etuja. Lautakunta vahvistaa salassa pidettävät tiedot toiminnanharjoittajan pyynnöstä. Tuotehakemusten ja kenttäkokeiden tiedot olisi jatkossa toimitettava ns. vakiotiedostomuodossa EU:n komission keskitettyyn sähköiseen tietojärjestelmään.
Asetuksen edellyttämien muutosten lisäksi muuntogeenisilla organismeilla tehtäviä kenttäkokeita koskevaa yleisön kuulemisaikaa lyhennettäisiin 60 päivästä 30 päivään. Tietyissä tilanteissa kuulemista ei tarvitsisi järjestää lainkaan.
Ehdotettu laki on tarkoitettu tulemaan voimaan mahdollisimman pian. Asetusta aletaan soveltaa 27.3.2021. Vakiotiedostomuotoja koskevat säännökset tulisivat kuitenkin voimaan valtioneuvoston asetuksella säädettävänä ajankohtana, koska EU:n keskitettyä sähköistä tietojärjestelmää koskeva valmistelu on vielä kesken komissiossa.
Hallituksen esitys geenitekniikkalain muuttamisesta pohjautuu elintarvikelainsäädäntöä koskevista yleisistä periaatteista ja vaatimuksista, Euroopan elintarviketurvallisuusviranomaisen perustamisesta sekä elintarvikkeiden turvallisuuteen liittyvistä menettelyistä annettuun Euroopan parlamentin ja neuvoston asetukseen (EY) N:o 178/2002, jäljempänä yleinen elintarvikeasetus, jota on muutettu elintarvikeketjuun sovellettavan EU:n riskinarvioinnin avoimuudesta ja kestävyydestä sekä asetusten (EY) N:o 178/2002, (EY) N:o 1829/2003, (EY) N:o 1831/2003, (EY) N:o 2065/2003, (EY) N:o 1935/2004, (EY) N:o 1331/2008, (EY) N:o 1107/2009 ja (EU) 2015/2283 sekä direktiivin 2001/18/EY muuttamisesta annetulla Euroopan parlamentin ja neuvoston asetuksella (EU) 2019/1381, jäljempänä läpinäkyvyysasetus. Läpinäkyvyysasetus on hyväksytty 20.6.2019 ja se on tullut voimaan 6.9.2019. Läpinäkyvyysasetuksen yhteydessä muutettiin myös geneettisesti muunnettujen organismien tarkoituksellisesta levittämisestä ympäristöön ja neuvoston direktiivin kumoamisesta 90/220/ETY annetun Euroopan parlamentin ja neuvoston direktiivin 2001/18/EY, jäljempänä avoimen käytön direktiivi, 6, 13, 25 ja 28 artiklaa, jotta varmistetaan direktiivin yhdenmukaisuus yleisen elintarvikeasetuksen uusien säännösten kanssa.
Avoimen käytön direktiivi on annettu EU:n toiminnasta annetun sopimuksen (SEUT) 114 artiklan nojalla. Direktiivi on ns. harmonisoiva säädös. Direktiivi on pantu täytäntöön kansallisesti geenitekniikkalailla (377/1995) ja sen nojalla annetuilla alempiasteisilla säädöksillä.
Direktiivi sääntelee muuntogeenisten organismienMuuntogeenisellä organismilla tarkoitetaan geenitekniikkalain (377/1995) 3 §:ssä määriteltyä eliötä, jonka perintöainesta on muutettu tavalla, joka ei toteudu luonnossa pariutumisen tuloksena tai luonnollisena yhdistelmänä. tarkoituksellista levittämistä ympäristöön. Avoimella käytöllä tarkoitetaan muuntogeenisillä organismeilla tehtäviä kenttäkokeita ja niitä sisältävien tuotteiden markkinoille saattamista. Kenttäkokeet voivat olla esimerkiksi viljelykasvien peltokokeita tai kliinisiä lääketutkimuksia. Tuotteet voivat olla esimerkiksi leikkokukkia. Sen sijaan avoimen käytön direktiivin perusteella ei hyväksytä elintarvikkeiksi ja rehuksi tarkoitettuja muuntogeenisiä organismeja sisältäviä tuotteita, joista säädetään muuntogeenisistä elintarvikkeista ja rehuista annetussa Euroopan parlamentin ja neuvoston asetuksessa (EY) N:o 1829/2003, jäljempänä EU:n elintarvike- ja rehuasetus. Avoimen käytön direktiiviä täydentävät eräät komission ja neuvoston päätökset. Avoimen käytön sääntelyllä pyritään varovaisuusperiaatteenVarovaisuusperiaate eli ennalta varautumisen periaate tarkoittaa, ettei tiettyihin ympäristöä tai kuluttajia suojeleviin toimenpiteisiin ryhtymistä saa estää se, että toimenpiteen seurauksista ei ole tarpeeksi tieteellistä varmuutta. Varovaisuusperiaate kuuluu kansainvälisen ympäristöoikeuden periaatteisiin. mukaisesti suojelemaan ihmisen ja eläinten terveyttä ja ympäristöä, kun muuntogeenisiä organismeja levitetään ympäristöön.
Avoimen käytön direktiivin C-osassa (13−24 artikla) tarkoitettuja tuotteiden markkinoille saattamista koskevia hakemusmenettelyjä ei sovelleta ihmisille ja eläimille tarkoitettuihin lääkkeisiin ja rokotteisiin, joille kuitenkin tehdään avoimen käytön direktiivin liitteessä II tarkoitettu ympäristöriskinarviointi myyntilupahakemuksen yhteydessä. Myyntilupaa edeltäviin kliinisiin lääketutkimuksiinKliininen lääketutkimus on lääketieteellisen tutkimuksen käsite, joka tarkoittaa ihmisillä tehtävää, yleensä lääkkeen tehon ja turvallisuuden osoittamiseen tähtäävää kokeellista tutkimusta. sekä muuntogeenisiä organismeja sisältävien lääkkeiden ja rokotteiden erityisluvalliseen käyttöönLääkealan turvallisuus- ja kehittämiskeskus Fimea voi yksittäistapauksissa myöntää erityisestä sairaanhoidollisesta syystä määräaikaisen luvan erityisluvalliseen käyttöön sellaiselle lääkevalmisteelle, jolla ei ole Suomessa myyntilupaa, jos mikään muu hoito ei tule kysymykseen tai ei anna toivottua tulosta. sovelletaan joko avoimen käytön direktiiviin B-osan mukaisia lupamenettelyjä (kenttäkokeet) tai geneettisesti muunnettujen mikro-organismien suljetusta käytöstäGeenitekniikkalain 3 §:n 1 momentin 5 kohdan mukaan suljettua käyttöä ovat toimet, joilla organismeja muunnetaan geenitekniikalla tai muuntogeenisiä organismeja kasvatetaan, säilytetään, siirretään, tuhotaan, hävitetään tai käytetään muulla tavalla ja joissa käytetään erityisiä eristämistoimenpiteitä organismien pääsyn rajoittamiseksi väestön keskuuteen tai ympäristöön väestön ja ympäristön turvallisuuden korkean tason varmistamiseksi. Usein kyse on yliopistojen tai muiden tutkimuslaitosten laboratorioissa tapahtuvasta biologian tai lääketieteen perustutkimuksesta. annetun Euroopan parlamentin ja neuvoston direktiivissä 2009/41/EY, jäljempänä suljetun käytön direktiivi, tarkoitettuja ilmoitus- tai hakemusmenettelyjä.
Läpinäkyvyysasetuksen johdanto-osan 41 kohdan mukaan asetus ei vaikuta asiakirjoihin tutustumista koskeviin oikeuksiin, jotka on vahvistettu Euroopan parlamentin, neuvoston ja komission asiakirjojen saamisesta yleisön tutustuttavaksi annetussa Euroopan parlamentin ja neuvoston asetuksessa (EY) N:o 1049/2001. Asetus ei myöskään vaikuta niihin oikeuksiin, joita tarkoitetaan tiedon saatavuutta, yleisön osallistumista päätöksentekoon sekä oikeuden saatavuutta ympäristöasioissa koskevan Århusin yleissopimuksen, jäljempänä Århusin sopimus, määräysten soveltamisesta yhteisön toimielimiin ja elimiin annetussa Euroopan parlamentin ja neuvoston asetuksessa (EY) N:o 1367/2006 ja ympäristötiedon julkisesta saatavuudesta ja neuvoston direktiivin 90/313/ETY kumoamisesta annetussa Euroopan parlamentin ja neuvoston direktiivissä 2003/4/EY. Läpinäkyvyysasetuksen säännökset ennakoivasta tietojen välittämisestä ja niihin liittyvä luottamuksellista käsittelyä koskevien pyyntöjen arviointi eivät saisi millään tavalla rajoittaa edellä mainituissa säädöksissä tarkoitettuja oikeuksia.
1.2.1 EU-säädöksen valmistelu
1.2.1.1 Yleinen elintarvikeasetus
Euroopan komission horisontaalisen REFIT-ohjelman (engl. Regulatory Fitness and Performance Programme) tarkoituksena on yksinkertaistaa EU-lainsäädäntöä ja vähentää sääntelyn kustannuksia. Osana kyseistä ohjelmaa on selvitetty, soveltuuko yleinen elintarvikeasetus edelleen tarkoitukseensa ja ovatko tavoitteiden saavuttamiseksi osoitetut työkalut toimivia. REFIT-ohjelman tavoitteena on selkeä, vakaa ja ennustettava sääntelykehys, joka samalla tukee kasvua ja työllisyyttä. Komission selvitysten ja verkkokyselyiden perusteella komissio julkaisi joulukuussa 2017 tiekartan elintarvikeketjun riskinarvioinnin avoimuudesta ja kestävyydestä EU:ssa (Ares (2017) 6265773). Tiekartasta pidetyssä julkisessa kuulemisessa ja verkkokyselyssä kerättiin näkemyksiä EU:n riskinarviointijärjestelmän avoimuudesta ja riippumattomuudesta erityisesti liittyen teollisuuden tekemiin tai teettämiin tutkimuksiin, joihin EU:n elintarviketurvallisuusviranomaisen (European Food Safety Authority, EFSA) riskinarviointi ja tieteelliset suositukset perustuvat. Näkemyksiä kerättiin myös riskiviestinnästä, EFSA:n hallinnoinnista ja jäsenvaltioiden roolista EU:n riskinarviointijärjestelmässä.
Selvitystyön seurauksena komissio antoi 11.4.2018 lainsäädäntöehdotuksen EU:n elintarvikeketjun riskinarvioinnin avoimuudesta ja kestävyydestä (KOM (2018) 179 lopullinen). Komission ehdotuksella esitettiin muutettavaksi yleisen elintarvikeasetuksen lisäksi myös muuntogeenisten organismien avoimen käytön direktiiviä. Yleisen elintarvikeasetuksen muuttamista koskevalla esityksellä ehdotettiin sekä tiukennettavaksi että selkeytettäväksi yleisen elintarvikeasetuksen säännöksiä riskinarvioinnin avoimuuden osalta. Lisäksi esityksen tavoitteena oli lisätä luottamusta EFSA:n riskinarvioinneissaan käyttämien tutkimusten uskottavuuteen, objektiivisuuteen ja riippumattomuuteen erityisesti tuotteiden hyväksymismenettelyiden yhteydessä. Muutoksella haluttiin myös parantaa EFSA:n hallinnointia, vahvistaa EFSA:n yhteistyötä jäsenvaltioiden kanssa sekä EFSA:n mahdollisuuksia ylläpitää korkeatasoisesta tieteellistä asiantuntemusta ja houkutella ansioituneita tieteellisiä asiantuntijoita tiedelautakuntien jäseneksi. Tavoitteena oli lisäksi luoda kattava ja tehokas riskiviestintästrategia ja EFSA:n hallinnoima EU:n sähköinen tietojärjestelmä, jäljempänä komission tietojärjestelmä, johon tallennetaan tutkimukset, joita hakija on tehnyt tai teettänyt hakemuksensa tueksi. Viranomaiset voivat hyödyntää näitä tutkimuksia esim. EU:n elintarvikkeiden nopean hälytysjärjestelmän (RASFF; engl. Food and Feed Safety Alerts) piiriin kuuluvissa tilanteissa, tuotevalvontatutkimuksissa sekä tuote-/ ympäristöriskinarvioinnissa ja -seurannassa yli kansallisten rajojen.
EU:n riskinarviointijärjestelmän läpinäkyvyyttä haluttiin myös parantaa varmistamalla, että hakemusten tueksi esitetty tieteellinen aineisto on pyynnöstä kaikkien jäsenvaltioiden ja yleisön saatavilla jo riskinarvioinnin varhaisessa vaiheessa. Toisaalta haluttiin selkeyttää sitä, minkälaiset tiedot voitaisiin hakemuksissa katsoa luottamuksellisiksi ja säätää tietojen luottamuksellisuuspyyntöjä koskevista menettelyistä.
Linkki EU:n yleiseen elintarvikeasetukseen (EY) N:o 178/2002: https://eur-lex.europa.eu/legal-content/FI/TXT/PDF/?uri=CELEX:32002R0178&from=FI
Linkki EU:n läpinäkyvyysasetukseen (EU) 2019/1381:https://eur-lex.europa.eu/legal-content/FI/TXT/PDF/?uri=CELEX:32019R1381&from=FI EU:n geenitekniikka- ja lääkesäädösten yhteensovittaminen
1.2.1.2 EU:n geenitekniikka- ja lääkesäädösten yhteensovittaminen
Muuntogeenisiä organismeja sisältäviä lääkevalmisteita ja rokotteita kehitetään kiihtyvään tahtiin, ja useat valmisteet ovat jo saaneet myyntiluvan maailmalla tai EU:ssa. Geenitekniikkalakia ei sovelleta myyntiluvan saaneisiin muuntogeenisiä organismeja sisältäviin lääkkeisiin ja -rokotteisiin, jos niitä käytetään myyntiluvan ehtojen mukaisesti. Tutkimus- ja tuotekehitysvaiheessa sekä eräissä muissa käyttötilanteissa muuntogeenisiä organismeja sisältäviin lääkkeisiin ja -rokotteisiin sovelletaan kuitenkin geenitekniikkalain 4 ja 5 luvun mukaisia ilmoitus- ja lupamenettelyjä. Tällaisia tilanteita ovat:
- lääkevalmisteeseen tai rokotteeseen tarkoitettujen muuntogeenisten organismien tutkimus tai niiden tuottaminen tutkimustarkoituksiin
- prekliiniset eli kliinistä koetta edeltävät tutkimukset
- kliiniset lääketutkimukset muuntogeenisiä organismeja sisältävillä lääkevalmisteilla tai -rokotteilla, joilla ei ole myyntilupaa tai kun lääketutkimuksessa poiketaan myyntiluvan ehdoista
- erityisluvalliset lääkkeet (engl. compassionate use).
Komissio perusti vuonna 2016 Ad hoc-työryhmän pohtimaan EU:n geenitekniikka- ja lääkesäädösten yhteensovittamista. Toimintaympäristön muuttuessa oli havaittu, ettei lääke- ja geenitekniikkasäädöksiä toimeenpanevien toimivaltaisten viranomaisten kansallinen ja EU-tason yhteistyö toimi toivotulla tavalla ja että eri jäsenvaltioissa myös tulkitaan säädöksiä eri tavalla. Tämä on haitannut muuntogeenisiä organismeja sisältävien valmisteiden tehoa ja turvallisuutta selvittävien kliinisten lääketutkimusten saamista EU:n alueelle ja hidastanut niiden myyntilupaprosesseja.
Työryhmä kartoitti heti työn alkuvaiheessa jäsenvaltioiden kansallisia käytäntöjä. Yhdeksi eroksi paljastuivat geenitekniikkadirektiivien mukaiseen lupamenettelyyn sisältyvät yleisön kuulemista koskevat kansalliset säädökset ja käytänteet. Niissä kansallista liikkumavaraa on ainoastaan kansallisissa viranomaisjärjestelyissä ja yleisön kuulemisen kestosta säätämisessä. Selvityksessä paljastui, että Suomessa yleisön kuulemisaika (60 pv) on EU:n pisin.
1.2.1.3 EU:n yleisen elintarvikeasetuksen hakemuksia koskevan tietojärjestelmän käytön laajentaminen tuote- ja kenttäkoehakemuksiin
Läpinäkyvyysasetuksen täytäntöönpanon myötä alun perin uuselintarvikkeiden hakemusmenettelyä varten luodun komission tietojärjestelmän käyttöä laajennetaan elintarvike- ja rehusektoreiden lisäksi avoimen käytön direktiivissä tarkoitettujen tuotehakemusten, käsittelyyn. Kyseessä on EU-komission kehittämä ja ylläpitämä www-pohjainen tietojärjestelmä, jonne hakija tekee hakemuksen ja toimittaa tarvittaessa lisätietoja.Linkki komission sähköiseen tietojärjestelmään: Hakija voi myös seurata hakemuksen käsittelyn etenemistä järjestelmässä. Järjestelmää tulevat käyttämään hakijat, komissio, jäsenvaltioiden toimivaltaiset viranomaiset sekä EFSA, jonka omiin tietojärjestelmiin mainittu komission tietojärjestelmä on integroitu. Järjestelmän käyttöä varten on valmisteltu sektorikohtaista ohjeistusta ja siihen järjestetään koulutusta. Jäsenvaltiot nimeävät säädöskohtaiset yhteyspisteet tietojärjestelmään toimitettujen hakemusten seurantaa varten. Kansallinen yhteyspiste Suomessa on geenitekniikan lautakunta. Valmistelut avoimen käytön direktiivin toimeenpanemiseksi tältä osin ovat vielä kesken.
1.2.1.4 Eduskuntakäsittely
Pääosa läpinäkyvyysasetuksen täytäntöönpanosta kuuluu maa- ja metsätalousministeriön toimialalle. Maa- ja metsätalousministeriö on laatinut komission esityksestä EU:n elintarvikeketjun riskinarvioinnin avoimuudesta ja kestävyydestä (KOM (2018) 179 lopullinen) E-kirjeen eduskunnalle 22.5.2018 (E 34/2018 vp)Linkki maa- ja metsätalousministeriön E-kirjeeseen (E 34/2018 vp):. Koska läpinäkyvyysasetuksella muutetut EU-säädökset ovat avoimen käytön direktiiviä lukuun ottamatta asetuksia, jotka ovat suoraan sovellettavaa oikeutta, ei asiasta ole pidetty tarpeellisena tehdä erillistä U-kirjelmää pelkästään avoimen käytön direktiivin osalta.
1.2.2 Hallituksen esityksen valmistelu
Esitys on valmisteltu virkatyönä sosiaali- ja terveysministeriössä.
Esitys on ollut lausunnolla 17.12.2020−22.1.2021 välisen ajan lausuntopalvelu.fi-palvelussa. Säädösvalmistelun kuulemisohjeiden mukaan (http://kuulemisopas.finlex.fi/) kirjallisten lausuntojen antamiseen varataan aikaa vähintään kuusi viikkoa ja laajoissa hankkeissa vähintään kahdeksan viikkoa. Lausuntoaikaa on aihetta pidentää, jos se ajoittuisi yleiseen lomakauteen. Lausuntoaika voi perustellusta syystä olla edellä mainittua lyhyempi.
Lausuntoaika oli hieman säädösvalmistelun kuulemisohjeita lyhyempi, koska kyseessä on suppea hallituksen esitys ja esityksellä pannaan täytäntöön EU:n läpinäkyvyysasetus, jota aletaan soveltaa 27.3.2021.
Esityksestä on pyydetty lausunnot ympäristöministeriöltä, maa- ja metsätalousministeriöltä, työ- ja elinkeinoministeriöltä, opetus- ja kulttuuriministeriltä, oikeusministeriöltä, valtiovarainministeriöltä, geenitekniikan lautakunnalta, Lääkealan turvallisuus- ja kehittämiskeskus Fimealta, Suomen ympäristökeskukselta, Ruokavirastolta, Luonnonvarakeskukselta, Tietosuojavaltuutetun toimistolta, biotekniikan neuvottelukunnalta, Helsingin yliopistolta (lääketieteellinen tiedekunta, bio- ja ympäristötieteellinen tiedekunta, maa- ja metsätaloustieteellinen tiedekunta, farmasian tiedekunta ja eläinlääketieteellinen tiedekunta), Tampereen yliopistolta (lääketieteen ja terveysteknologian tiedekunta ja tekniikan ja luonnontieteiden tiedekunta), Turun yliopistolta (lääketieteellinen tiedekunta ja luonnontieteiden ja tekniikan tiedekunta), Jyväskylän yliopistolta (matemaattis-luonnontieteellinen tiedekunta), Itä-Suomen yliopistolta (luonnontieteiden ja metsätieteiden tiedekunta ja terveystieteiden tiedekunta), Boreal Kasvinjalostus Oy:ltä, Kauppapuutarhaliitto ry:ltä, Maa- ja metsätaloustuottajain Keskusliitto MTK ry:ltä, Perunantutkimuslaitokselta, Siemenkauppiaiden yhdistys ry:ltä, Rokotetutkimuskeskukselta, Lääketeollisuus ry:ltä, Kuluttajaliitto- Konsumentförbundet ry:ltä, Suomen Luonnonsuojeluliitto ry:ltä ja Luomuliitto ry:ltä. Lausuntoja saatiin yhteensä 14 kappaletta, joiden lisäksi esityksestä saatiin yksi kansalaiskannanotto. Lausuntokierroksen jälkeen esitykseen tehdyt muutokset on saatettu geenitekniikan lautakunnalle tiedoksi 19.2.2021 pidetyssä lautakunnan kokouksessa.
Lainsäädännön arviointineuvosto on antanut lausuntokierroksen jälkeen esityksestä vielä lausuntonsa.
Hallituksen esityksen valmisteluasiakirjat ovat julkisessa palvelussa osoitteessa https://valtioneuvosto.fi/hankkeet.
Lailla geenitekniikkalain muuttamisesta pannaan täytäntöön EU:n uusi läpinäkyvyysasetus. Mainitun asetuksen muutoksen yhteydessä muutettiin myös avoimen käytön direktiivin 6, 13, 25 ja 28 artiklaa, jotta varmistetaan direktiivin yhdenmukaisuus yleisen elintarvikeasetuksen uusien säännösten kanssa. Mainittuihin direktiivin muutettuihin säännöksiin sisältyy velvoitteita, jotka jäsenvaltioiden on pantava täytäntöön kansallisesti mm. siltä osin kuin on kyse vakioiduista tiedostomuodoista 6 artiklan 1 kohdassa ja 13 artiklan 1 kohdassa tarkoitetuissa hakemuksissa sekä hakemuksissa esitettyjen tietojen luottamuksellisuudesta ja luottamuksellisuuspyyntöjen käsittelystä.
Avoimen käytön direktiivissä sinällään säädetään kenttäkokeiden yleisökuulemisesta, mutta sille ei direktiivissä ole säädetty määräaikaa.
Avoimen käytön direktiiviin tehtyjen muutosten tavoitteena on parantaa EU:ssa ylikansallisten muuntogeenisten organismien lupamenettelyiden avoimuutta ja läpinäkyvyyttä. Itse hallituksen esityksellä mahdollistetaan kansallisista tarpeista johtuen jatkossa nykyistä nopeampi kenttäkoehakemusten käsittely ja parannetaan hakemuksiin liittyvien henkilötietojen suojaa.
Yleisen elintarvikeasetuksen muuttaminen läpinäkyvyysasetuksella edellytti myös kahdeksan muun EU-säädöksen muuttamista, jotta turvattaisiin yleiseen elintarvikeasetukseen tehtyjen muutosten johdonmukaisen soveltaminen ja määriteltäisiin yhdenmukaisesti, millaisia tietoja voidaan pitää luottamuksellisina. Muutetuista säädöksistä muuntogeenisten organismien tarkoituksellista levittämistä ympäristöön koskevat avoimen käytön direktiivi sekä EU:n elintarvike- ja rehuasetus.
Muut läpinäkyvyysasetuksella muutetut EU-säädökset ovat:
1) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1831/2003, annettu 22 päivänä syyskuuta 2003, eläinten ruokinnassa käytettävistä lisäaineista;
2) Euroopan parlamentin ja neuvoston asetus (EY) N:o 2065/2003, annettu 10 päivänä marraskuuta 2003, elintarvikkeissa käytettävistä tai käytettäviksi tarkoitetuista savuaromeista;
3) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1935/2004, annettu 27 päivänä lokakuuta 2004, elintarvikkeen kanssa kosketukseen joutuvista materiaaleista ja tarvikkeista ja direktiivien 80/509/ETY ja 89/109/ETY kumoamisesta;
4) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1331/2008, annettu 16 päivänä joulukuuta 2008, elintarvikelisäaineiden, elintarvike-entsyymien ja elintarvikearomien yhtenäisestä hyväksymismenettelystä;
5) Euroopan parlamentin ja neuvoston asetus (EY) N:o 1107/2009, annettu 21 päivänä lokakuuta 2009, kasvinsuojeluaineiden markkinoille saattamisesta sekä neuvoston direktiivien 79/117/ETY ja 91/414/ETY kumoamisesta; ja
6) Euroopan parlamentin ja neuvoston asetus (EU) 2015/2283, annettu 25 päivänä marraskuuta 2015, uuselintarvikkeista, Euroopan parlamentin ja neuvoston asetuksen (EU) N:o 1169/2011 muuttamisesta sekä Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 258/97 ja komission asetuksen (EY) N:o 1852/2001 kumoamisesta.
2.3.1 Hakemusten käsittely EU:ssa
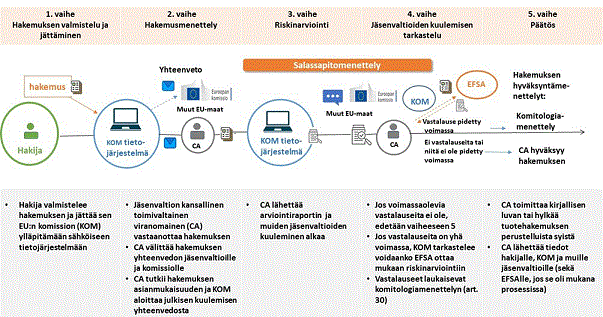
Avoimen käytön direktiivissä tarkoitettujen tuotehakemusten käsittelyssä EFSA:n rooli on erilainen kuin EU:n elintarvike- ja rehuasetuksessa tarkoitettujen tuotehakemusten käsittelyssä, jossa EFSA:n rooli on hyvin keskeinen. Avoimen käytön direktiivissä tarkoitettu hakemus muuntogeenisen tuotteen markkinoille saattamisesta jätetään jonkin jäsenvaltion toimivaltaiselle viranomaiselle. Vahvistettuaan hakemuksen asianmukaisuuden kyseinen toimivaltainen viranomainen laatii arviointiraportin, jonka se toimittaa muille jäsenvaltioille ja komissiolle. Hakemuksen saatuaan komissio käynnistää siitä tarkastelumenettelyn sekä yleisön kuulemisen, joista säädetään yleisistä säännöistä ja periaatteista, joiden mukaisesti jäsenvaltiot valvovat komission täytäntöönpanovallan käyttöä, annetun Euroopan parlamentin ja neuvoston asetuksen (EU) N:o 182/2011, ns. komitologia-asetuksen, 5 artiklassa. Tiedekomiteoita tai EFSA:a kuullaan komitologiamenettelyssä vain, jos arviointikertomuksen laatinut toimivaltainen viranomainen tai komissio on esittänyt ja pitänyt voimassa vastalauseen muuntogeenisistä organismeista aiheutuvista riskeistä ihmisten terveydelle tai ympäristölle tai jos arviointikertomuksessa todetaan, ettei kyseistä organismia tule saattaa markkinoille. Tällöin komissio kuulee omasta aloitteestaan tai jäsenvaltion pyynnöstä tiedekomiteaa tai tiedekomiteoita mainitusta vastalauseesta. Komissio voi myös joko omasta aloitteestaan tai jäsenvaltion pyynnöstä kuulla tiedekomiteaa tai tiedekomiteoita kaikissa avoimen käytön direktiivin soveltamisalaan kuuluvissa asioissa, jotka voivat vaikuttaa haitallisesti ihmisten terveyteen ja ympäristöön ilman, että tämä vaikuttaa direktiivissä säädettyihin hallinnollisiin menettelyihin. Riippumatta siitä, hyväksytäänkö vai hylätäänkö hakemus komitologiamenettelyssä, kansallinen viranomainen antaa aina asiassa päätöksen. Käytännössä kansallinen toimivaltainen viranomainen vahvistaa komitologiamenettelyssä tehdyn päätöksen, ja toimittaa päätöksen hakijalle.
Avoimen käytön direktiivissä tarkoitettujen kenttäkoehakemusten käsittelyssä EFSA:lla ei ole direktiivissä säädettyjä tehtäviä. Kenttäkoehakemus jätetään sen jäsenvaltion toimivaltaiselle viranomaiselle, jossa tutkimus aiotaan toteuttaa. Useassa EU-maassa toteutettavassa monikeskustutkimuksessa hakemus jätetään jokaisessa jäsenvaltiossa erikseen. Kansallinen toimivaltainen viranomainen järjestää hakemuksesta yleisön kuulemisen. Lisäksi kenttäkoehakemuksesta tiedotetaan komissiota. Muilla jäsenvaltioilla on mahdollisuus antaa lausunto kenttäkoehakemuksesta. Hakemuksen hyväksymisestä päättää kuitenkin aina kansallinen toimivaltainen viranomainen.
Komission ja muiden jäsenvaltioiden rooli on kenttäkoehakemusten osalta neuvoa-antava, mikä poikkeaa tuotehakemuksen hyväksymisprosessista, jossa komission ja muiden jäsenvaltioiden rooli on puolestaan yhtä tärkeä kuin alkuperäisen jäsenvaltion, johon hakija on jättänyt hakemuksensa.
2.3.2 Kansallisen ja EU-viranomaisen roolit tuotehakemuksen tietojen luottamuksellisuuden arvioinnissa
Avoimen käytön direktiivin mukaiset lupahakemukset ovat julkisia asiakirjoja, joista järjestetään yleisön kuuleminen. Hakemuksiin voi kuitenkin sisältyä luottamuksellista tietoa, kuten henkilötietoja tai liikesalaisuuksia, joita hakija voi perustellusta syystä pyytää käsiteltäväksi luottamuksellisina. Hakemuksen vastaanottanut kansallinen lupaviranomainen voi avoimen käytön direktiivin 25 artiklan mukaan myöntää pyynnöstä luottamuksellisen käsittelyn tiedoille, ellei tietoja ole säädetty julkistettaviksi ja jos hakijan esittämät perustelut täyttävät säädöksissä mainitut käsittelyn luottamuksellisuuden edellytykset. Lupaviranomainen huolehtii siitä, ettei hakemuksen julkisessa versiossa ole luottamuksellisia tietoja. Kyseinen menettely on sama kuin nykyisinkin, mutta läpinäkyvyysasetuksen yhteydessä avoimen käytön direktiiviin tehdyissä muutoksissa määritellään aiempaa tarkemmin, millaisia tietoja voidaan pitää luottamuksellisina ja mitkä tiedot on julkistettava.
Kansallinen toimivaltainen viranomainen voi joutua käsittelemään luottamuksellisuuspyyntöjä aiempaa useammin, jos EFSA:lta pyydetään hakemuksesta lausuntoa ja EFSA tällöin pyytää hakijalta lisätietoja. Tällöin kansallinen toimivaltainen viranomainen käsittelee myös hakijan toimittamiin lisätietoihin liittyvät luottamuksellisuuspyynnöt, joita voi olla useita. Läpinäkyvyysasetuksen nojalla EFSA puolestaan on vastaava tietojen luottamuksellisuuden määrittelevä viranomainen, mikä on merkittävä eroavaisuus luottamuksellisten tietojen käsittelyssä läpinäkyvyysasetuksen ja avoimen käytön direktiivin välillä. Vaikka kansallinen viranomainen päättääkin salassapidosta, on todettava, että EFSA:lla on kuitenkin mahdollisuus antaessaan lausuntoa hakemuksesta avoimen käytön direktiivin 28 (4) artiklan nojalla päättää tuotehakemuksia koskevien tietojen salassapidosta vielä hakemuksen jättämisen jälkeenkin.
2.3.3 Komission ohje avoimen käytön direktiivin mukaisten tuotehakemusten toimittamisesta
Komissio on aloittanut jäsenvaltioiden kanssa vuoropuhelun avoimen käytön direktiiviin tehtyjen muutosten toimeenpanosta tuotehakemusten osalta. Komissio on esittänyt 12.11.2020 ohjeluonnoksen läpinäkyvyysasetuksen sekä avoimen käytön direktiivin toimeenpanosta. Komissio on tämän jälkeen jatkanut vuoropuhelua jäsenvaltioiden kanssa ohjeesta, jonka toimeenpano muuttaisi tuotehakemusten hakemusmenettelyitä siten, että jo ennen hakemuksen jättämistä hakija voisi pyytää EFSA:lta yleistä neuvontaa hakemusmenettelystä ja uusintahakemuksen tapauksessa myös hakemuksen tueksi mahdollisesti suunnitelluista tutkimuksista ennen niiden toteuttamista. Hakija toimittaisi tiedot komission tietojärjestelmään neuvontaa varten. Myöhemmin hakija toimittaa myös varsinaisen hakemuksensa kyseisen tietojärjestelmän kautta kansalliselle toimivaltaiselle viranomaiselle. Jäsenvaltion toimivaltaisella viranomaisella, joka käsittelee hakijan pyynnöt hakemuksessa esitettyjen tietojen luottamuksellisuudesta, olisi puolestaan vastuu siitä, että komission tietojärjestelmässä on saatavilla hakemuksesta julkinen toisinto, joka ei sisällä luottamuksellista tietoa.
Jos kyse on uusintahakemuksesta, EFSA käynnistäisi julkisen kuulemisen hakijan uusintahakemuksen tueksi suunnittelemista tutkimuksista sen selvittämiseksi, onko hakemuksen kannalta mahdollisesti olemassa muutakin relevanttia tieteellistä aineistoa. Julkisessa kuulemisessa saamiensa huomautusten pohjalta EFSA antaisi hakijalle neuvontaa. Myös hakemuksen vastaanottavalla jäsenvaltion toimivaltaisella viranomaisella olisi mahdollisuus halutessaan osallistua neuvontaan ja saada EFSA:lta tietoa sen antamista neuvoista sen jälkeen, kun hakemus on jätetty. Kun hakemuksen tueksi esitettävät tutkimukset on asetettu julkisesti saataville, EFSA käynnistäisi uusintahakemuksesta yleisön kuuleminen. EFSA arvioisi kuulemisen jälkeen hakemusten tueksi esitettyä tieteellistä aineistoa. Komissio voisi myös erityistapauksissa pyytää EFSA:a tekemään tutkimukset hakemuksen tueksi esitetyn näytön varmentamiseksi. Komission ohjeen olisi tarkoitus olla käytettävissä, kun läpinäkyvyysasetusta aletaan soveltaa 27.3.2021.
Kuva 1: Avoimen käytön direktiivin C-osan mukaisen tuotehakemuksen tietojen uusi käsittelyprosessi EU:ssa salassapitomenettelyineen. CA = toimivaltainen viranomainen (engl. Competent Authority).
Århusin sopimus on kansainvälinen yleis- ja ympäristösopimus, jossa vahvistetaan perussäännöt, joilla pyritään edistämään kansalaisten mahdollisuutta vaikuttaa heidän elinympäristöään koskeviin päätöksiin. Sopimuksessa mukana olevat osapuolivaltiot takaavat kansalaisilleen oikeuden saada tietoa ja osallistua päätöksentekoon ympäristöasioissa sekä niitä koskevan vireillepano- ja muutoksenhakuoikeuden. Euroopan yhteisö allekirjoitti yhdessä kaikkien jäsenvaltioidensa kanssa Århusin sopimuksen vuonna 1998, ja sopimus astui voimaan 30.10.2001, jolloin sen oli ratifioinut 17 maata. Suomessa eduskunta hyväksyi sopimuksen 21.6.2004. Tasavallan presidentti antoi tämän jälkeen asetuksen (866/2004) tiedon saannista, yleisön osallistumismahdollisuudesta päätöksentekoon sekä muutoksenhaku- ja vireillepano-oikeudesta ympäristöasioissa tehdyn yleissopimuksen voimaansaattamisesta ja yleissopimuksen lainsäädännön alaan kuuluvien määräysten voimaansaattamisesta annetun lain voimaantulosta. Sopimuksen voimaanpanoasetus tuli Suomessa voimaan 30.11.2004.
Århusin sopimusta on täydennetty myöhemmin muuntogeenisiä organismeja koskevalla ns. Almatyn lisäyksellä (27.5.2005). Lisäyksellä korvattiin Århusin sopimuksen 6 artiklan 11 kohta uudella 6 artiklan 11 kohdalla sekä lisättiin sopimukseen uusi 6 bis artikla ja uusi liite I bis. Artiklassa 6 bis edellytetään sopimuksen osapuolten mahdollistavan yleisölle tiedonsaannin ja osallistumisen päätöksentekoprosessiin ennen kuin tehdään päätös muuntogeenisten organismien tarkoituksellista levittämistä ympäristöön. Artiklassa todetaan, että sen tarkoituksena on täydentää YK:n biologista monimuotoisuutta koskevaan sopimukseen (ns. biodiversiteettisopimus) liittyvän Cartagenan bioturvallisuuspöytäkirjan tavoitteita, jotka osapuolet ovat ottaneet huomioon kansallisissa bioturvallisuutta koskevissa säädöksissä. Liitteessä I bis edellytetään, että yleisön kuuleminen sisällytetään kansalliseen lainsäädäntöön eräitä liitteessä I bis mainittuja poikkeustilanteita lukuun ottamatta. Liitteessä I bis määritellään myös, millaisia tietoja ei voida pitää luottamuksellisina, ja siinä edellytetään, että muuntogeenisten organismien tarkoituksellista levittämistä koskevat päätökset asetetaan yleisön saataville. Suomi on ratifioinut Almatyn lisäyksen 10.6.2008. Lisäys ei kuitenkaan ole vielä voimassa, sillä voimaantuloon vaadittavien ratifiointien määrä ei ole vielä täyttynyt. EU:ssa Århusin sopimus on muuntogeenisten organismien osalta pantu täytäntöön sekä avoimen että suljetun käytön direktiiveillä.
Avoimen käytön direktiivin 9 ja 24 artiklassa säädetään yleisölle hakemuksista annettavista tiedoista ja yleisön kuulemisesta. Artiklan vaatimukset ovat yhdenmukaisia Århusin sopimuksen kanssa. Avoimen käytön direktiivin 9 ja 24 artikla on pantu täytäntöön Suomessa geenitekniikkalain 36 b §:llä.
Århusin sopimuksen Almatyn lisäyksessä ei aseteta yleisön kuulemiselle varsinaista vähimmäisaikaa, mutta aikaa pitäisi antaa ”riittävästi”, jotta se riittää yleisön mielipiteen ilmaisemiseen. Århusin yleissopimuksen täytäntöönpano-oppaassaLinkki Århusin sopimuksen täytäntöönpano-oppaaseen: . United Nations Economic Commission for Europe; The Aarhus Convention An Implementation Guide; Convention on Access to Information, Public Participation in Decision-making and Access to Justice in Environmental Matters (Aarhus Convention); Second edition, 2014. on yleinen kuulemista koskeva ohje, jossa kuulemisaika kytketään tietopyyntöön vastaamiselle asetettuun määräaikaan. Täytäntöönpano-oppaan 6 bis artiklaa koskevassa osiossa todetaan, että kuulemiseen varattu aika vaihtelee eri maissa. Århusin sopimus jättää täten sopimuksen osapuolille liikkumavaraa kuulemisen määräajan täytäntöönpanossa.
Muuntogeenisillä organismeilla tehtävät kenttäkokeet ja niitä sisältävien tuotteiden saattaminen markkinoille EU:ssa on aina luvanvaraista. Muuntogeenisten organismien tarkoituksellista levittämistä ympäristöön koskeva kansallinen lainsäädäntö perustuu EU-lainsäädäntöön sekä kansainvälisiin ympäristösopimuksiin. Vaikka muuntogeenisiä organismeja koskeva EU-lainsäädäntö on pitkälti kehitetty muuntogeenisiä kasveja varten, se koskee myös muuntogeenisiä mikro-organismeja ja eläimiä. Lainsäädäntö on pysynyt pääpiirteissään samana 1990-luvun alusta asti, mutta toimintaympäristö on muuttunut EU:ssa huomattavasti varsinkin viimeisten 10 vuoden kuluessa.
3.1.1 Kenttäkokeet
Geenitekniikkasääntelyn alkuaikoina EU:ssa lähes kaikki kenttäkoehakemukset koskivat muuntogeenisillä kasveilla tehtäviä peltokokeita, mutta vuonna 2020 jätetyistä hakemuksista enää alle 10 % koski kasveja. Sen sijaan muuntogeenisiä organismeja sisältävillä lääkkeillä tai rokotteilla tehtäviä kliinisiä lääketutkimuksia koskevien hakemusten määrät ovat kasvaneet vuosi vuodelta.
Kenttäkokeisiin sovelletaan Suomessa geenitekniikkalain 5 luvun mukaista hakemusmenettelyä. Suomessa jätettyjen kenttäkoehakemusten määrät ovat vaihdelleet; keskimäärin niitä on jätetty kuitenkin vuosittain vain yksi. Kenttäkoehakemukset koskivat geenitekniikan lautakunnan toiminnan alkuvuosina viljelykasveja (peruna, sokerijuurikas, ohra, rapsi) tai mikrobeja, nyttemmin metsäpuita (koivu, hybridihaapa) tai rokotteita.
Geenitekniikkalain mukaisia lupamenettelyjä noudatetaan myös muuntogeenisiä organismeja sisältävien lääkkeiden ja rokotteiden tutkimus- ja tuotekehitysvaiheessa sekä eräissä muissa käyttötilanteissa. Lääkevalmisteisiin tarkoitettujen muuntogeenisten organismien tuottaminen tutkimustarkoituksiin ja niillä tehtävä tutkimus ovat yleensä suljettua käyttöä, johon sovelletaan geenitekniikkalain 4 luvun mukaisia ilmoitusmenettelyjä. Sen sijaan kliiniset lääketutkimukset ennen myyntilupaa tai myyntiluvan ehdoista poiketen katsotaan Suomessa tapauksesta riippuen joko suljetuksi käytöksi tai kenttäkokeiksi. Sama koskee muuntogeenisten lääkevalmisteiden erityisluvallista käyttöä (engl. compassionate use).
Vuosina 2015−2019 Fimealle jätettiin kliinisistä lääketutkimuksista 137−184 hakemusta vuosittain. Näistä 2−7 hakemusta vuodessa koski geenihoitoa, somaattista soluhoitoa tai muuntogeenisiä organismeja sisältävää lääkettä.Fimean tilastotietoja kliinisistä lääketutkimuksista:
3.1.2 Tuotteiden saattaminen markkinoille
Avoimen käytön direktiivissä tarkoitetut tuotehyväksynnät ovat nykyisin hyvin harvinaisia. Direktiivin nojalla voidaan hyväksyä muut kuin elintarvikkeena tai rehuna markkinoille saatettavat tuotteet esim. koristekasvit. Tällä hetkellä EU:ssa on avoimen käytön direktiivin nojalla hyväksyttyinä tuotteina markkinoilla ainoastaan leikkoneilikoita, jotka ovat kukanväriltään muunnettuja. Tuotehakemuksen keskitetty hyväksymismenettely EU:ssa on mittava. Sen kustannukset hakijalle ovat arviolta 10−15 miljoonaa euroa ja prosessi kestää yli 5 vuotta. Suomessa geenitekniikan lautakunnalle ei ole jätetty yhtään tuotehakemusta vuoden 1996 jälkeen.
Muuntogeenisillä organismeilla tehtävien kliinisten lääketutkimusten kasvu on vähitellen alkanut näkyä myös lääkevalmisteiden myyntiluvissa, ja useat valmisteet ovat jo saaneet myyntiluvan maailmalla tai EU:ssa. Alan tutkimus- ja kehitystyö on hyvin aktiivista. Tammikuun 2018 ja heinäkuun 2020 välisenä aikana Euroopan lääkevirasto (engl. European Medicines Agency; EMA) antoi 100 tieteellistä lausuntoa muuntogeenisiä virusvektoreita tai muuntogeenisiä soluja sisältävistä geeniterapiatuotteista. Sairauksia, joiden hoitoon on jo kehitetty muuntogeenisiä organismeja sisältäviä terapiavalmisteita ovat mm. eräät etenevät neurologiset sairaudet, kuten lihastaudit, sekä tietyt silmä- ja syöpäsairaudet. Toistaiseksi EU:ssa on saanut myyntiluvan viisi muuntogeenisiä virusvektoreita sisältävää valmistetta ja viisi muuntogeenisiin soluihin pohjautuvaa valmistetta. Kaksi muuta myyntilupapäätöstä on tällä hetkellä vireillä. Myyntiluvan on saanut myös viisi ihmisrokotetta, joista osa on koronavirusrokotteita, sekä useita eläinrokotteita.
Geenitekniikkalakia ei sovelleta myyntiluvan saaneisiin muuntogeenisiä organismeja sisältäviin lääkkeisiin ja -rokotteisiin, jos niitä käytetään myyntiluvan ehtojen mukaisesti.
3.1.3 Lupahakemuksiin sisältyvien tietojen toimittamista koskevat vaatimukset ja salassapidon merkitseminen
Ennen kuin tuotteina tai tuotteissa oleva muuntogeeninen organismi tai organismien yhdistelmä saatetaan EU:ssa markkinoille avoimen käytön direktiivin mukaisesti, toiminnanharjoittajan on tehtävä siitä lupahakemus jonkin jäsenvaltion kansalliselle toimivaltaiselle viranomaiselle (Suomessa geenitekniikan lautakunnalle). Toimivaltainen viranomainen toimittaa hakemuksen julkisen tiivistelmän välittömästi muiden jäsenvaltioiden toimivaltaisille viranomaisille ja EU:n komissiolle. Riskien arvioimiseksi sekä terveys- ja ympäristövaikutusten tunnistamiseksi hakemuksen on sisällettävä avoimen käytön direktiivin 13 artiklan 2 kohdassa tarkoitetut tiedot.
Kenttäkoehakemus jätetään sen jäsenvaltion toimivaltaiselle viranomaiselle, jossa tutkimus aiotaan toteuttaa. Kansallinen toimivaltainen viranomainen järjestää hakemuksesta yleisön kuulemisen ja toimittaa tätä varten julkisen tiivistelmän hakemuksesta. Samoin tiivistelmä toimitetaan myös komissiolle, joka toimittaa sen muiden jäsenvaltioiden toimivaltaisille viranomaisille, jotka voivat esittää huomioitaan hakemuksesta. Riskien arvioimiseksi sekä terveys- ja ympäristövaikutusten tunnistamiseksi hakemuksen on sisällettävä avoimen käytön direktiivin 6 artiklan 2 kohdassa tarkoitetut tiedot.
Toimivaltainen viranomainen tutkii viipymättä, onko hakemus laadittu tämän lain mukaisesti ja pyytää tarvittaessa toiminnanharjoittajalta lisätietoja. Toiminnanharjoittajan tekemä lupahakemuksen peruutus ei estä jättämästä hakemusta myöhemmin muulle EU:n jäsenvaltion toimivaltaiselle viranomaiselle.
Suomessa tuote- ja kenttäkoehakemuksen sisällöstä ja hakemusmenettelystä säädetään tarkemmin muuntogeenisten organismien tarkoituksellisesta levittämisestä annetussa sosiaali- ja terveysministeriön asetuksessa (1105/2019). Tällä hetkellä hakemuksen sisältämien tietojen luovuttamisesta päättää geenitekniikan lautakunta, joka toiminnanharjoittajaa kuultuaan ratkaisee, mitä tietoja tulee pitää salassa.
Geenitekniikkalaissa ei ole nykyisin säädetty erikseen menettelytavoista, jotka koskevat luottamuksellisten tietojen käsittelyä hakemuksen jättämisvaiheessa, jolloin toimivaltaisen viranomaisen pitää laatia hakemuksesta julkinen versio yleisökuulemista varten.
3.1.4 Kenttäkoetta koskevan yleisön kuulemisen määräaika
Ennen muuntogeenisellä organismilla tehtävää kenttäkoetta toiminnanharjoittajan on jätettävä siitä hakemus kansalliselle toimivaltaiselle viranomaiselle. Koska kenttäkokeella voi olla vaikutusta kansalaisten elinympäristöön, hakemuksesta järjestetään Århusin sopimuksen ja avoimen käytön direktiivin edellyttämä yleisön kuuleminen, jonka pituudesta voidaan säätää kansallisesti. Kuulemisajan pituuteen on liittynyt Suomessa ongelmia, jotka ovat lisääntymässä geenitekniikkasäädösten soveltamisalaan kuuluvan toimintaympäristön muututtua.
Muuntogeenisiä organismeja sisältävällä lääkevalmisteella tehtävät kenttäkokeet kuuluvat EU:ssa lääkelainsäädännön lisäksi avoimen käytön direktiivin soveltamisalaan. Avoimen käytön direktiivissä säädetyt lupamenettelyt eivät kuitenkaan kaikin osin sovellu lääke- ja rokotetutkimuksiin tai lääkevalmisteen erityisluvalliseen käyttöön, sillä direktiivi on alun perin tarkoitettu lähinnä muuntogeenisiä kasveja koskevien tuote- ja kenttäkoehakemusten käsittelyyn. Lääkelainsäädännön nojalla kliinisistä lääketutkimuksista ei järjestetä yleisökuulemista. On huomioitava, että myöskään suljetun käytön ilmoituksista ei yleensä järjestetä kuulemisia.
Lain 36 b §:ssä tarkoitettu 60 päivän kuulemisaika on osoittautunut ongelmalliseksi tilanteissa, joissa geenitekniikan lautakunnan pitäisi tehdä nopeasti päätös muuntogeenisellä organismilla tehtävästä kenttäkokeesta geenitekniikkalain 18 §:n nojalla. Tämä lupamenettelyn määräaika on 120 päivää. Lisäselvitysten tarve voi kuitenkin pidentää asian käsittelyaikaa jopa 5−6 kuukauteen. Tämä on omiaan hidastamaan kliinisten lääketutkimusten järjestämistä ja muuntogeenisiä organismeja sisältävien lääkkeiden erityisluvallista käyttöä. Lisäksi tilanteessa, jossa tutkimusryhmä haluaisi suorittaa muuntogeenisillä kasveilla kenttäkokeen, mutta hakemus tutkimussuunnitelmineen pystytään jättämään geenitekniikan lautakunnalle vasta alkukeväästä, koetta ei ehkä pystytä järjestämään kyseisellä kasvukaudella. Tämä saattaa olla ongelma esimerkiksi, jos koe on osa opinnäytetyötä, jonka hankerahoitus on päättymässä.
Århusin sopimus, sen täytäntöönpano EU:n suljetun sekä avoimen käytön direktiiveissä tai kansalliset ympäristösäädökset eivät edellytä nykyistä 60 päivän kuulemisaikaa. Lisäksi nykyiset sähköiset järjestelmät tehostavat yleisön tiedonsaantia sekä helpottavat osallistumista kuulemiseen. Näin ollen kuulemisaikaa on perusteltua lyhentää.
4.1.1 Yleistä
Läpinäkyvyysasetuksen muutokset ja sen yhteydessä tehdyt muut säädösmuutokset on pantava täytäntöön jäsenvaltioissa 27.3.2021 mennessä eräitä poikkeuksia lukuun ottamatta. Geenitekniikkalailla kansallisesti täytäntöön pantaviksi tulevat avoimen käytön direktiivin säädösmuutokset, jotka koskevat hakemusten toimittamista vakiotiedostomuotojen mukaisesti (6 ja 13 artikla) sekä tietojen luottamuksellisuutta (25 ja 28 artikla). Läpinäkyvyysasetuksen 39 e artiklan henkilötietojen suojaa ja 41 artiklan viranomaisen asiakirjajulkisuutta koskevat säännökset tulevat sen sijaan sovellettaviksi avoimen käytön direktiivin osalta ainoastaan soveltuvin osin. Näistä 41 artiklan säännökset on jo aiemmin pantu täytäntöön kansallisesti viranomaisten toiminnan julkisuudesta annetussa laissa (621/1999), jäljempänä julkisuuslaki, ja geenitekniikkalaissa, joten ne eivät edellytä muutoksia geenitekniikkalakiin.
4.1.2 Tuote- ja kenttäkoehakemuksissa annettavien tietojen luottamuksellisuuden käsittely
Avoimen käytön direktiiviin tehtyjen muutosten täytäntöönpanemiseksi geenitekniikkalaissa täsmennettäisiin tietojen salassapitoa koskevaa sääntelyä siten, että hakijan olisi hakemuksen jättämisvaiheessa kirjattava hakemukseensa salassa pidettävät tiedot, joiden salassapito ratkaistaan jo ennen tietojen toimittamista komissiolle ja muille jäsenvaltioille. Komission tietojärjestelmään on toimitettava hakemuksesta julkinen versio, josta salassa pidettävät tiedot on poistettu. EU:n komission sähköinen tietojärjestelmä on uusi työkalu, jonka kautta hakemus tehdään. Jos hakemuksesta olisi kuitenkin hyväksymisen jälkeen tarpeen luovuttaa tietoja, noudatettaisiin lain 32 §:n 3 momenttia, jolloin toiminnanharjoittajaa voitaisiin vielä lähtökohtaisesti kuulla erikseen tietojen luovuttamisesta.
Avoimen käytön direktiivin 25 artikla koskee kenttäkoe- ja tuotehakemuksissa toimitettujen tietojen luottamuksellisuutta. Artiklan johdosta ehdotetaan lakiin lisättäväksi uusi 32 a §, jonka mukaan geenitekniikkalain 17 ja 20 §:ssä tarkoitettujen hakemusten osalta geenitekniikan lautakunta voisi toiminnanharjoittajan pyynnöstä vahvistaa salassapidon tiedoille, joiden paljastamisen toiminnanharjoittaja on todennettavien syiden perusteella osoittanut voivan vahingoittaa merkittävästi sen etuja. Tietyt liikesalaisuudet määritellään luettelonomaisesti salassa pidettäviksi toisin kuin julkisuuslain 24 §:n 20 kohdassa, jossa liikesalaisuus määritellään yleisellä tasolla. Päätös tehtäisiin hakemuksen julkisen, komission tietojärjestelmään toimitettavan version luomiseksi ennen kuin hakemuksesta järjestetään yleisön kuuleminen. Päätöksen ajallinen ulottuvuus määräytyisi lähtökohtaisesti julkisuuslain mukaan.
Edellytyksenä luetteloitujen liikesalaisuuksien salassapidolle on, että toiminnanharjoittaja voi osoittaa tietojen paljastamisen voivan vahingoittaa merkittävästi sen etuja. Kynnys vahinkoedellytyksen soveltamiseen on momentin mukaan korkeampi kuin julkisuuslain vastaavaan 24 §:n 20 kohdan mukaan. Julkisuuslain mainitussa säännöksessä vahinkoedellytyksen soveltaminen liittyy elinkeinonharjoittajalle aiheutuvaksi oletettuun ”taloudelliseen vahinkoon”.
Salassa voidaan myös pitää sellaisten luonnollisten henkilöiden nimet ja osoitteet, jotka osallistuvat selkärankaisilla eläimillä tehtyyn testaukseen tai toksikologisten tietojen hankkimiseen geenitekniikkalain 17 ja 20 §:ssä tarkoitettuihin hakemusmenettelyihin liittyvissä tieteellisissä selvityksissä, kuten tieteellisissä lausunnoissa. Koska henkilötietojen julkistamisen voitaisiin katsoa tällaisessa tilanteessa vahingoittavan merkittävästi kyseisten luonnollisten henkilöiden yksityisyyttä ja koskemattomuutta, niitä ei edellytettäisi asetettavaksi julkisesti saataville, jollei henkilötietojen suojaa koskevissa säädöksissä toisin säädetä.
Geenitekniikkalain 17 ja 20 §:ssä tarkoitettuihin hakemusmenettelyihin liittyvissä tieteellisissä selvityksissä, kuten tieteellisissä lausunnoissa, esitettyjä henkilötietoja ei kuitenkaan pidetä salassa pidettävinä. Julkisia henkilötietoja olisivat paitsi toiminnanharjoittajan nimi ja osoite, myös pyyntöä tukevien julkaistujen tai julkisesti saatavilla olevien tutkimusten tekijöiden nimet, sekä selvityksiin osallistuneiden tieteellisten komiteoiden ja paneelien, niiden työryhmien ja muiden asiaa käsittelevien ad hoc -työryhmien kokouksiin osallistuneiden ja niissä tarkkailijoina toimineiden nimet. Muutoin hakemusmenettelyissä noudatettaisiin, mitä julkisuuslain 24 §:n 1 momentin 31 kohdassa säädetään.
Geenitekniikan lautakunnalla olisi kuitenkin mahdollisuus julkaista salassa pidettävät tiedot tilanteissa, joissa kiireelliset toimet ovat välttämättömiä ihmisten terveyden, eläinten terveyden tai ympäristön suojelemiseksi. Tiedot, jotka muodostavat osan asiaankuuluvan tiedekomitean tai asiaankuuluvien tiedekomiteoiden esittämien tieteellisten selvitysten päätelmiä tai arviointikertomusten päätelmiä ja jotka liittyvät ihmisten terveyteen, eläinten terveyteen tai ympäristöön kohdistuviin ennakoitavissa oleviin vaikutuksiin, on joka tapauksessa julkaistava. Toiminnanharjoittajan suojaksi normaalisti säädetyn salassapidon raukeaminen perustuu tällöin tilanteen synnyttämään välttämättömyys-edellytykseen. Kyseessä on suojalausekkeen tyyppinen mekanismi, jota voidaan käyttää esim. hätätilanteissa. Salassa pidettävistä tiedoista tehdystä päätöksestä voidaan hakea muutosta sen mukaan, mitä lain 44 §:ssä säädetään.
4.1.3 Hakemuksissa käytettävät vakiotiedostomuodot
Avoimen käytön direktiivi koskee hakemuksia, jotka toimivaltaiselle viranomaiselle on toimitettava, kun muuntogeenisiä organismeja halutaan levittää ympäristöön muussa kuin markkinoillesaattamistarkoituksessa (6 artikla; kenttäkokeet) tai markkinoille saatettavina tuotteina (13 artikla). Mainittujen artikloiden edellyttämien hakemusten vakiotiedostomuotojen johdosta ehdotetaan geenitekniikkalain 17 ja 20 §:n muuttamista siten, että hakemus edellytetään toimitettavaksi EU-lainsäädännön nojalla hyväksyttyjen vakiotiedostomuotojen mukaisesti.
Vakiotiedostomuodot mahdollistavat asiakirjojen toimittamisen, hakemisen, kopioinnin ja tulostamisen siten, että samalla varmistetaan unionin lainsäädännössä vahvistettujen sääntelyvaatimusten noudattaminen sekä asian tehokas käsittely. Vakiotiedostomuodoista säädetään tarkemmin läpinäkyvyysasetuksen 39 f artiklassa, jossa todetaan, etteivät ne saa perustua valmistajakohtaisiin standardeihin ja että niiden yhteentoimivuus olemassa olevien tietojen toimittamismuotojen kanssa on varmistettava mahdollisuuksien mukaan, ja että niiden on oltava käyttäjäystävällisiä ja mukautettuja pienten ja keskisuurten yritysten käyttöön. Luonnokset vakiotiedostomuodoiksi laatii EFSA, ja komissio hyväksyy ne täytäntöönpanosäädöksillä.
Tällä hetkellä EU:n komission sähköinen -tiedonhallintajärjestelmä, johon tuotehakemukset ja niihin liittyvät tiedot on tarkoitus keskitetysti toimittaa, on tulossa käyttöön, kun läpinäkyvyysasetusta aletaan soveltaa 27.3.2021. Vakiotiedostomuotojen valmistelu on kuitenkin edelleen kesken EFSA:ssa. Komissiolta saadun tiedon mukaan on epätodennäköistä, että ne olisivat valmiina, kun läpinäkyvyysasetusta aletaan soveltaa 27.3.2021. Tämän vuoksi lain ehdotetun 17 §:n 3 momentin sekä 20 §:n 3 momentin voimaantulosta säädettäisiin lain siirtymäsäännöksen mukaisesti erillisellä valtioneuvoston voimaanpanoasetuksella. Kenttäkoehakemusten osalta komission tietojärjestelmään siirtyminen vie todennäköisesti vielä useita vuosia.
4.1.4 Yleisön kuuleminen kenttäkokeissa
Geenitekniikkalain mukaan geenitekniikan lautakunnan on myönnettävä lupa kenttäkokeeseen, jos riskinarvioinnissa ei ole todettu vaaraa ihmisen tai eläinten terveydelle tai ympäristölle ja hakemuksen tekniset asiakirjat on laadittu lain mukaisesti. Yleisön kuulemisessa esille tulevista seikoista kenttäkoeluvan myöntämiseen voivat vaikuttaa siis vain ne, jotka liittyvät riskinarviointiin tai hakemuksen teknisiin puutteisiin. Lain 36 b §:n 2 momentissa tarkoitettu 60 päivän määräaika yleisön kuulemiselle lyhennettäisiin 30 päivään. Kuuleminen voitaisiin kuitenkin jättää kokonaan toteuttamatta, jos kyse on kiireellisestä lääkinnällisestä tutkimuksesta, toimenpiteestä tai hoidosta, jonka tarkoituksena on ihmisen hengen tai terveyden turvaaminen tai jos kuuleminen on omiaan vaarantamaan tutkimuksen, toimenpiteen tai hoidon kohteena olevan henkilön yksityisyyden suojan.
Hallituksen esityksessä ei esitetä muutoksia muihin kansallisiin säädöksiin, jotka koskevat kyseisten lääkevalmisteiden lupamenettelyjä.
Toimintaympäristön muututtua viime vuosina kenttäkokeissa on useimmiten kyse joko kliinisistä lääketutkimuksista tai sellaisen lääkevalmisteen erityisluvallisesta käytöstä, jonka myyntilupaprosessi lääkelainsäädännön nojalla on kesken. Erityisluvallisessa käytössä kyse on yleensä yksittäisistä tai hyvin harvoista potilaista, ja myös kliinisissä lääketutkimuksissa osallistujia saattaa olla hyvin vähän, jos kyse on esimerkiksi harvinaissairaudesta. Tällöin pitkittyneestä lupamenettelystä johtuva hoidon viivästyminen saattaa joissakin tilanteissa jopa vaarantaa potilaan hengen tai terveyden. Lisäksi tällaisissa tilanteissa yleisön kuulemisessa julkistettavat tiedot kokeen tarkoituksesta ja sijaintipaikasta voivat joissakin tapauksissa riittää yksilöimään potilaan, joka saa lääkevalmistetta erityisluvalla tai osallistuu kliiniseen lääketutkimukseen. Yleisön kuulemista koskeva vaatimus on tällöin ristiriidassa henkilötietojen suojaa koskevan sääntelyn kanssa. Henkilötietojen suojelussa on huomioitava luonnollisten henkilöiden suojelusta henkilötietojen käsittelyssä sekä näiden tietojen vapaasta liikkuvuudesta ja direktiivin 95/46/EY kumoamisesta annettu Euroopan parlamentin ja neuvoston asetus (EU) 2016/679, jäljempänä tietosuoja-asetus, jota on alettu soveltaa 25.5.2018 lukien. Tietosuoja-asetus on EU-asetuksena suoraan sovellettavaa oikeutta jäsenvaltioissa. Potilastiedot ovat henkilötietoja, ja niiden käsittelyyn sovelletaan tietosuoja-asetusta, jota on täydennetty ja täsmennetty kansallisella lainsäädännöllä mm. tietosuojalailla (1050/2018), potilaan asemasta ja oikeuksista annetulla lailla (785/1992) sekä terveydenhuollon asiakastietojen sähköisestä käsittelystä annetulla lailla (159/2007). Säädösristiriidan takia ehdotetaan, ettei yleisön kuulemista toteutettaisi edellä mainituissa kiireellisissä tilanteissa tai, jos kuuleminen olisi omiaan vaarantamaan henkilötietojen suojan.
4.2.1 Julkiseen talouteen kohdistuvat vaikutukset
Hakemusten vakiotiedostomuodot yhteneväistävät ja tehostavat hakemusten käsittelyä EU:n sisällä. Tämä helpottaa lupaviranomaisten tehtävää ja yhteistyötä etenkin silloin, kun hakemus koskee useassa EU-maassa tehtävää lääkkeitä tai rokotteita koskevaa monikeskustutkimusta. Toisaalta vaatimus sitoo lupaviranomaiset ja -asiantuntijalaitokset tiettyihin tiedostomuotoihin ja niiden käsittelyyn soveltuviin ohjelmistoihin. Toimivaltaisille viranomaisille vakiotiedostomuotojen käyttöön ottamisesta voi aiheutua kustannuksia, jos tarvittavien ohjelmistojen käyttö edellyttää maksullisia lisenssejä.
Tällä hetkellä vakiotiedostomuotojen tarkasta formaatista ei ole vielä tietoa, joten lisenssitarvetta ei voida arvioida. On kuitenkin epätodennäköistä, että muutoksesta aiheutuisi suuria kustannuksia viranomaisille, sillä läpinäkyvyysasetuksen mukaan vakiotiedostomuodot eivät saa perustua valmistajakohtaisiin standardeihin ja niiden yhteentoimivuus olemassa olevien tietojen toimittamismuotojen kanssa on varmistettava mahdollisuuksien mukaan. Lisäksi vakiotiedostomuotojen on oltava käyttäjäystävällisiä ja mukautettuja pienten ja keskisuurten yritysten käyttöön.
Kun saadaan tarkempaa tietoa käyttöön tulevista vakiotiedostomuodoista, on lisäksi arvioitava nykyisen, teknisesti jo vanhentuneen geenitekniikan rekisterin soveltuvuus vakiotiedostomuotojen käsittelyyn ja siitä mahdollisesti aiheutuvat rekisterin tekniset uudistustarpeet. Ideaalitilanteessa tarvittavat muutokset voidaan toteuttaa geenitekniikan lautakunnan lupatoiminnan digitalisaation yhteydessä, mihin sisältyy myös Fimean ylläpitämän geenitekniikan rekisterin uudistaminen. Digitalisointiin ei ole kuitenkaan varattu vielä resursseja. Jos vakiotiedostomuodot tulevat kuitenkin käyttöön ennen mainittuja geenitekniikan rekisterin uudistuksia, joutuu Fimea varautumaan muutostarpeisiin jo tätä aiemmin. Vakiotiedostomuotojen käyttöön ottamisen aiheuttamiksi kertaluonteisiksi henkilöresurssitarpeiksi arvioidaan 0,2 henkilötyövuotta, kun geenitekniikan rekisterin mahdollisia teknisiä muutostarpeita ei huomioida laskennassa. Koska vakiotiedostomuodoista ei ole toistaiseksi saatavilla riittävästi tietoa, mahdollisten geenitekniikan rekisterin teknisten muutosten aiheuttamaa resurssitarvetta ei ole mahdollista arvioida tässä vaiheessa.
Esityksestä voi aiheutua lisätyötä Fimealle myös, jos muuntogeenisillä organismeilla tehtävien kliinisten lääketutkimusten määrä lisääntyisi huomattavasti. Tämä edellyttäisi Fimealta lisäresursseja geenitekniikkalain mukaiseen valvontaan. GMO-valvontaan Fimeassa nykyisin osoitettu resurssi on 1 htv. Geenitekniikan lautakunnan ja ulkopuolisen esittelijän palkkiot sekä sihteeristön henkilöstökulut maksetaan sosiaali- ja terveysministeriön budjettimomentilta. Geenitekniikkalain mukaisista suoritteista perittävistä maksuista säädetään erillisellä geenitekniikkalain mukaisten suoritteiden maksullisuudesta annetulla valtioneuvoston asetuksella (1255/2018). Tämä asetus uudistetaan kolmen vuoden välein. Nykyinen asetus on voimassa 31.12.2021 saakka. Tällä hetkellä tuotehakemuksen käsittelymaksu on 6 600 euroa ja kenttäkoehakemuksen käsittelymaksu on 3 300 euroa geenitekniikan lautakunnassa. Geenitekniikan lautakunnan vuosittaiset tulot geenitekniikkalain mukaisista suoritteista ovat olleet noin 10 000−20 000 euroa. Tulot koostuvat lähes yksinomaan suljetun käytön ilmoituksista perityistä maksuista.
Kenttäkoehakemuksia ei ole jätetty geenitekniikan lautakunnalle vuoden 2018 jälkeen, joten geenitekniikan lautakunnalle ei viime vuosina ole syntynyt niistä kuluja tai tuloja. Toiminnanharjoittajilta saatujen tietojen perusteella v. 2021 on mahdollisesti tulossa käsiteltäväksi kaksi kenttäkoehakemusta. Kenttäkoehakemusten käsittelystä toiminnanharjoittajilta perityt maksut ovat aiempina vuosina laskennallisesti kattaneet käsittelystä aiheutuvat kulut, eikä lakimuutoksen odoteta muuttavan tilannetta ainakaan lyhyellä aikavälillä.
Geenitekniikan lautakunnalle ei ole jätetty tuotehakemuksia vuoden 1996 jälkeen. Tässä esityksessä geenitekniikan lautakunnalle ehdotetut uudet velvoitteet tulevat nostamaan tuotehakemusten käsittelyn kustannuksia. Tuotehakemukselle tällä hetkellä määritelty maksu ei vastaa enää nykyistä kustannustasoa huomioiden esimerkiksi tuotteen ympäristöriskinarvioinnin viimeksi v. 2019 kiristyneet vaatimukset EU:ssa. Näin ollen maksuasetuksen seuraavan uusimisen yhteydessä jouduttaneen tuotehakemusten käsittelymaksuja huomattavasti nostamaan.
Yleisön kuulemista koskevien määräaikojen lyhentämisellä ei ole vaikutusta geenitekniikan lautakunnan resursseihin, koska yleisön kuuleminen toteutetaan aiemmin käytössä ollutta Virallista lehteä tehokkaammin viranomaisen verkkosivuilla sekä mahdollisia muita nykyaikaisia viestintäkanavia hyödyntäen. Tämä mahdollistaa kuulemisen järjestämisen aiempaa kustannustehokkaammin.
4.2.2 Yrityksiin ja tutkimuslaitoksiin kohdistuvat vaikutukset
Yrityksiä, joilla on muuntogeenisiä organismeja sisältäviä tuotteita koskevaa tutkimus- ja kehittämistoimintaa ja joihin ehdotettuja muutoksia sovellettaisiin, on Suomessa melko vähän. Geenitekniikan rekisterin perusteella niistä suurin osa (15−20 kpl) on terveydenhuoltoon suuntautuneita yrityksiä, joiden toimialana on lääkekehitys tai diagnostiikka. Lääkekehitystä ja diagnostiikkaa tekevät myös yliopistojen tutkimusryhmät, tietyt tutkimuslaitokset ja sairaanhoitopiirit. Tämän lisäksi Suomessa on joitakin teollisia entsyymejä tuottavia yrityksiä, mutta niiden toiminnassa on kyse suljetusta käytöstä, johon esitetyillä muutoksilla ei ole vaikutusta.
Suuri osa kliinisistä lääketutkimuksista Suomessa tehdään ulkomaisten lääkeyritysten toimeksiannosta. Suomalaiset osapuolet ovat tällöin yleensä alan asiantuntijapalveluita tarjoavia yrityksiä, jotka hoitavat tutkimuksen lupamenettelyt viranomaisten kanssa. Käytännön kliininen tutkimus tehdään tyypillisesti yliopistollisissa sairaaloissa tai muissa terveydenhuollon yksiköissä.
Suomessa on v. 1995 jälkeen jätetty 25 kenttäkoehakemusta, joista noin puolet on ollut yritysten ja puolet yliopistojen ja tutkimuslaitosten tekemiä.
Hakemusten yhteneväiset tiedostomuodot tehostaisivat hakemusten käsittelyprosesseja ja yhtenäistäisivät niitä EU:n sisällä, mikä helpottaa monikeskustutkimuksia suunnittelevien yritysten, erityisesti lääkeyritysten, toimintaa. Toisaalta vaatimus sitoo toiminnanharjoittajat tiettyihin tiedostomuotoihin ja ohjelmistoihin, joilla niitä voidaan käsitellä. Toiminnanharjoittajan hakemuksen tueksi keräämien tutkimusaineistojen konvertoinnista voi aiheutua hakijalle vähäisiä lisäkustannuksia, jos ne ovat sellaisessa tiedostomuodossa, että niiden käsittelyyn tarvitaan uusia maksullisia ohjelmistoja. Tämä on kuitenkin epätodennäköistä, sillä läpinäkyvyysasetuksen 39 f artiklassa säädetään, etteivät vakiotiedostomuodot saa perustua valmistajakohtaisiin standardeihin ja että niiden yhteensopivuus olemassa olevien tietojen toimittamismuotojen kanssa on varmistettava mahdollisuuksien mukaan. Lisäksi niiden on oltava käyttäjäystävällisiä ja mukautettuja pienten ja keskisuurten yritysten käyttöön. Lisäksi mahdolliset ohjelmistohankinnat ja -lisenssit olisivat kertaluonteisia kustannuseriä. Vakiotiedostomuotoihin siirtyminen aiheuttaa siirtymävaiheessa yrityksissä tarpeen kouluttaa henkilöstön niiden käyttöön, mutta tarvittavat henkilöresurssit ovat tyypillisesti pienet.
Kenttäkoe- ja tuotehakemusten käsittely geenitekniikan lautakunnassa on toiminnanharjoittajille maksullista. Tällä hetkellä tuotehakemuksen käsittelymaksu on 6 600 euroa ja kenttäkoehakemuksen käsittelymaksu on 3 300 euroa.
Kenttäkokeen järjestämisen kokonaiskustannukset toiminnanharjoittajalle voivat vaihdella suuresti. Ne riippuvat monista tekijöistä kuten esimerkiksi kokeen luonteesta (esim. viljely- vai rokotekoe), materiaalikustannuksista ja kokeen laajuudesta (kesto, pinta-ala, osallistujien henkilömäärä). Kenttäkoehakemuksen laatimisesta ja lupamenettelyistä aiheutuvat kustannukset muodostavat tästä vain pienen osan. Esimerkiksi lääkekehityksessä kliinisten lääketutkimusten kustannukset liikkuvat tapauksesta riippuen muutamasta sadasta miljoonasta eurosta noin pariin miljardiin.
Tuotehakemuksen käsittelymaksua joudutaan säädösmuutosten takia huomattavasti nostamaan tulevaisuudessa, mikä lisäisi yritysten hallinnollisia kustannuksia jossain määrin, jos ne jättävät tuotehakemuksensa Suomessa geenitekniikan lautakunnalle.
Kenttäkoetoimintaa koskevat taloudelliset vaikutukset kohdistuisivat todennäköisesti eniten pieniin ja keskisuuriin yrityksiin sekä korkeakouluissa ja tutkimuslaitoksissa toimiviin tutkimusryhmiin. Yritystoimintaan kohdistuvien vaikutusten Suomessa arvioidaan kuitenkin olevan äärimmäisen pienet, sillä muuntogeenisten organismien tarkoituksellinen levittäminen ympäristöön joko tuotteina tai kenttäkokeissa on EU:n raskaan geenitekniikkalainsäädännön takia nykyään liki olematonta.
Poikkeuksen muodostavat muuntogeenisiä organismeja sisältävillä lääkkeillä ja rokotteilla tehtävät kliiniset lääketutkimukset sekä niiden käyttö erityisluvalla, sillä erilaisia terapeuttisia valmisteita koskeva tutkimus ja tuotekehittely lisääntyvät jatkuvasti. Terapeuttisten valmisteiden myyntilupaprosessiin EU:ssa ei sovelleta avoimen käytön direktiiviä. Näillä valmisteilla tehtäviä kliinisiä lääketutkimuksia voivat kuitenkin koskea direktiivin mukaiset kenttäkokeiden lupamenettelyt. Tällöin yleisön kuulemisajan lyhentäminen voi nopeuttaa Suomessa lääketutkimusten hyväksyntää geenitekniikan lautakunnan lupamenettelyn osalta, mikä osaltaan parantaa lääkeyritysten kilpailukykyä erityisesti kansainvälisissä monikeskustutkimuksissa.
Nykyisin käytännössä vain suuryrityksillä on mahdollisuus hakea EU:ssa markkinointilupaa muuntogeenisiä organismeja sisältäville tuotteille, eivätkä ehdotetut muutokset muuta tätä tilannetta. EU-tuomioistuimen 25.7.2018 asiassa C-528/16 antaman, uusien genominmuokkaustekniikoiden juridista statusta koskevan tuomion (EUVL C 328, 17.9.2018, s. 4−5) seurauksena on myös hyvin epätodennäköistä, että EU:ssa sijaitseva, perinteistä geenitekniikkaa uudempia genominmuokkaustekniikoita hyödyntävä tutkimus- ja tuotekehitystoiminta tuottaisi uusia tuotteita EU-markkinoille nykyisten geenitekniikkasäädösten voimassa ollessa lukuun ottamatta edellä mainittuja lääkkeitä ja rokotteita.
Edellä todetun lisäksi geeniteknisten sovellusten kehittämiseen ja kaupallistamiseen vaikuttavat luonnollisesti yleinen markkinatilanne, kansainvälinen kilpailu, kehittämisen kalleus, siihen vaadittavat investoinnit ja aika, sekä markkinoillepääsyn edellyttämien lupamenettelyiden sujuvuus. Suomen markkinat ovat pienet, eivätkä pohjoisiin oloihin tarvittavat sovellukset välttämättä ole suurten, monikansallisten yhtiöiden intresseissä.
Ehdotetut muutokset tietojen luottamuksellisuuden käsittelyssä voisivat teoriassa pidentää lupahakemusten käsittelyaikaa, jos toiminnanharjoittaja ja toimivaltainen viranomainen ovat erimielisiä luottamuksellisuuden perusteiden täyttymisestä. Koska lain 32 a §:ään ehdotettavat muutokset kuitenkin selkeyttävät, mitä tietoja voidaan pitää luottamuksellisina, tulkintaerimielisyyksien oletetaan vähenevän toimivaltaisen viranomaisen ja toiminnanharjoittajan välillä. Täten luottamuksellisuuden käsittely ei aiheuttaisi yrityksille lisäkustannuksia.
Yleisön kuulemisajan lyhentäminen parantaisi Suomen kilpailukykyä, kun kyseessä ovat muuntogeenisillä organismeilla suoritettavat kliiniset lääketutkimukset. Yritykset etsivät sopivia paikkoja kliinisen lääketutkimuksen toteuttamiseen, jolloin lyhyempi kuulemisaika voisi olla omiaan houkuttelemaan toiminnan aloittamiseen Suomessa.
Ehdotuksen vaikutukset suomalaisen teollisuuden kilpailukykyyn rajoittuvat kuitenkin vain lääkesektoriin, sillä suomalainen kasvin-, metsän- ja eläinjalostus ei EU:n geenitekniikkasääntelyn takia kykene hyödyntämään geenitekniikoita kaupallisesti. Suomessa on useita suuriakin biotekniikkayrityksiä, jotka käyttävät muuntogeenisiä mikro-organismeja esimerkiksi entsyymituotantoon, mutta avoimen käytön direktiiviä ei sovelleta kyseiseen toimintaan. Ehdotetuilla muutoksilla ei olisi myöskään vaikutusta yrityksiin, jotka haluavat tuoda markkinoille muuntogeenisiä elintarvikkeita tai rehuja, sillä nämä eivät kuulu geenitekniikkalain soveltamisalaan.
4.2.3 Viranomaisten toimintaan kohdistuvat vaikutukset
Ensimmäistä kertaa jätettävien tuotehakemusten kohdalla EFSA voisi jatkossa antaa hakijalle yleisiä ohjeita hakemusmenettelyistä. Tämä ei sulje pois kansallisen toimivaltaisen viranomaisen mahdollisuutta tai velvoitetta osallistua hakijan neuvontaan hakemusmenettelyistä, mutta voi parantaa hakemusten laatua ja siten helpottaa niiden käsittelyvaiheessa kansallisen viranomaisen työtä. Jo markkinointiluvan saaneen tuotteen luvan uusimista koskevien hakemusten osalta EFSA voisi jatkossa antaa uusintahakemuksen jättämistä edeltävässä julkisessa kuulemisessa saamiensa huomautusten pohjalta hakijalle neuvontaa, joka koskee uusintahakemuksen tueksi aiottuja tutkimuksia. Tietojen saaminen uusintahakemuksen tueksi mahdollisesti suunnitelluista tutkimuksista jo ennen tutkimusten toteuttamista olisi hakijalle sekä arvioijalle hyödyksi ja tehostaisi hakemusten arviointia ja käsittelyä.
Hakemuksen vastaanottavan kansallisen viranomaisen mahdollisuus osallistua yhdessä EFSA:n kanssa neuvontaan edesauttaa vuorovaikutusta EFSA:n ja toimivaltaisten viranomaisten välillä, kun kansallinen viranomainen arvioi hakemuksen asianmukaisuutta. Hakemuksen "ei-luottamuksellisen" version laatiminen lisännee toimivaltaisen viranomaisen työtaakkaa, koska se joutuu todennäköisesti käsittelemään luottamuksellisuuspyyntöjä aiempaa useammassa hakemuksen käsittelyvaiheessa. Tämä tulee ottaa huomioon viranomaisresurssien mitoituksessa, jotta hakemuksen käsittely pystyttäisiin suorittamaan määräajassa.
Vakiotiedostomuotoihin ja komission sähköiseen tietojärjestelmään siirtyminen edellyttää toimivaltaisen viranomaisen henkilöstön kouluttautumista niiden käyttöön. Myös viranomaisen asiointipalveluiden sisältämät tiedot ja lomakkeet on päivitettävä. Hakemusmenettelyjen muutoksista on myös laadittava ohjeet eri kieliversioilla sekä tiedotettava näistä lautakunnan verkkosivuilla ja Suomi.fi-palvelussa. Vaikutus on kertaluontoinen, mutta saattaa ajoittua pitkällekin aikajaksolle riippuen siitä, milloin komissio hyväksyy vakiotiedostomuodot. Vaikutukset on Suomessa huomioitava geenitekniikan lautakunnan resursseissa, kun vakiotiedostomuotojen käyttöön oton laajuus ja ajankohta selviävät.
Komission sähköinen tietojärjestelmä ei todennäköisesti ole yhteensopiva geenitekniikan rekisterin ja biologista monimuotoisuutta koskevaan yleissopimukseen liittyvä Cartagenan bioturvallisuuspöytäkirjassa tarkoitettu bioturvallisuuden tiedonvälitysjärjestelmän (engl. Biosafety Clearing House) kanssa. Tästä johtuen lautakunnan sihteeristö joutuu jatkossakin kirjaamaan tai toimittamaan samoja hakemuksia ja lupia koskevia tietoja useaan eri tietojärjestelmään.
Tietojen luottamuksellisuuden käsittelyyn ehdotetut muutokset eivät edellytä suuria muutoksia nykyisiin käytäntöihin. Suurimmat vaikutukset liittyvät läpinäkyvyysasetuksen toimeenpanoa koskevassa komission ohjeluonnoksessa esitettyihin EFSA:n, komission ja toimivaltaisten viranomaisten yhteistyömenettelyihin, jotka lisäävät tuotehakemusten käsittelyyn liittyvää työmäärää ja aiheuttavat geenitekniikan lautakunnalle suuria aikatauluhaasteita.
Avoimen käytön direktiivin mukaisia tuotehakemuksia ei tämänhetkisen arvion mukaan kuitenkaan ole tulossa geenitekniikan lautakunnan käsiteltäväksi lähivuosina, joten käytännössä esityksestä johtuvat viranomaisvaikutukset aiheutuvat kenttäkoehakemuksia koskevista muutoksista.
Geenitekniikan lautakunnalle tulee lisääntyvissä määrin kliinisiä lääketutkimuksia koskevia tiedusteluja. Kuitenkin vain osa niistä johtaa sellaisen tutkimushankkeen toteuttamiseen, johon sovelletaan avoimen käytön direktiiviä. Muuntogeenisiä organismeja sisältäviä lääkevalmisteita ja rokotteita koskevien myyntilupahakemusten määrä Euroopassa on niin ikään kasvanut. Toimivaltaisena viranomaisena lautakunta ottaa kantaa näiden Euroopan lääkevirastolle jätettyjen myyntilupahakemusten ympäristöriskinarviointeihin, mikä myös on lisännyt sen tehtäviä. Tällä hetkellä ei ole nähtävissä, että esityksellä olisi suoraa vaikutusta myyntilupahakemusten määrään. Ehdotetuilla muutoksilla voi olla vaikutusta geenitekniikan lautakunnalle jätettävien kenttäkoehakemusten määrään, jos yleisön kuulemisajan lyhentäminen ja EU:n lääke- ja geenitekniikkasäädöksiä koskevan harmonisointityö lisäävät lääkeyritysten kiinnostusta järjestää kliinisiä lääketutkimuksia entistä useammissa EU:n jäsenvaltioissa.
Geenitekniikan lautakunta on sosiaali- ja terveysministeriön yhteydessä toimiva monijäseninen toimielin, jossa on edustettuna viisi eri ministeriötä, sekä alan tieteellinen asiantuntemus. Lautakunnalla on sihteeristö, jonka henkilöstöresurssit ovat 2,5 henkilötyövuotta. Lisäksi lautakunnalla on tällä hetkellä viisi ulkopuolista esittelijää, jotka laskuttavat työstään tuntiperusteisesti. Esittelijät käsittelevät vuosittain 20−50 uutta suljetun käytön ilmoitusta tai hakemusta sekä aiempiin ilmoituksiin liittyviä tiedonantoja erilaisista muutoksista. Lautakunnan kokouksia järjestetään 10−15 kertaa vuodessa.
Nykytilanteessa lautakunnan sihteeristön sekä esittelijöiden resurssit riittävät kliinisiä lääketutkimuksia koskevien ilmoitusten ja hakemusten käsittelyyn sekä Euroopan lääkeviraston käsittelemien lääkkeiden myyntilupahakemusten ympäristöriskinarviointien kommentointiin. Jos kliinisiä lääketutkimuksia koskevien ilmoitusten ja hakemusten lukumäärä lisääntyy, tilanne voi muuttua sekä geenitekniikan lautakunnan että kokeita geenitekniikkalain mukaan valvovan viranomaisen, Fimean osalta.
Yleisön kuulemisajan lyhentäminen 60 päivästä 30 päivään tehostaa geenitekniikan lautakunnan työtä kenttäkoehakemusten lupamenettelyissä. Lisäksi kuulemisesta ehdotetaan tietyissä tilanteissa luovuttavaksi. Muuntogeenisillä organismeilla suoritettavien kliinisten lääketutkimusten järjestäminen ja erityisluvallinen käyttö edellyttävät Suomessa lisäksi, että niistä jätetään lupahakemus Fimealle ja eettisille toimikunnille. Lakimuutoksilla ei ole vaikutusta näihin lupamenettelyihin, jotka ovat täysin erilliset geenitekniikkalain mukaisista lupamenettelyistä.
4.2.4 Ympäristöön kohdistuvat vaikutukset
Ehdotetut muutokset eivät vaikuttaisi muuntogeenisten organismien ympäristöriskinarviointiin käytettäviin menetelmiin, riskinarvioinnissa vaadittaviin tietoihin tai riskinarvioinnin sisältöön. Täten esityksellä ei ole suoria vaikutuksia ympäristöön. Vakiotiedostomuotojen käytöllä hakemuksissa pyritään helpottamaan ympäristöriskinarvioinnissa tarvittavien tietojen käsittelyä ja tietojenvaihtoa EU:ssa.
Tietojen luottamuksellisuutta koskeva osio määrittelee entistä tarkemmin, millaisia tietoja toiminnanharjoittaja voi pyytää luottamuksellisiksi. Tiedot, jotka muodostavat osan joko asiaankuuluvan tiedekomitean tai asiaankuuluvien tiedekomiteoiden esittämien tieteellisten selvitysten päätelmiä tai arviointikertomusten päätelmiä ja jotka liittyvät ihmisten terveyteen, eläinten terveyteen tai ympäristöön kohdistuviin ennakoitavissa oleviin vaikutuksiin, olisi joka tapauksessa julkaistava. Tällä varmistetaan ympäristöä koskevien tietojen avoimuus.
4.2.5 Yhteiskuntaan kohdistuvat vaikutukset
4.2.5.1 Vakiotiedostomuotojen vaikutukset
Muutosehdotukset, joilla edellytetään hakemuksiin liittyvien tietojen toimittamista vakiotiedostomuodossa, helpottavat tulevaisuudessa ei-luottamuksellisten tietojen toimittamista yleisön saataville. Julkisuuslaki ja digitaalisten palvelujen tarjoamisesta annettu laki (306/2019), jolla on täytäntöön pantu julkisen sektorin elinten verkkosivustojen ja mobiilisovellusten saavutettavuudesta annettu Euroopan parlamentin ja neuvoston direktiivi (EU) 2016/2102, edellyttävät, että tiedot toimitetaan kansalaisille saavutettavassa muodossa. Vakiotiedostomuotoihin siirtymisen ei arvioida aiheuttavan kansalaisille tietojen saamiseen liittyviä kuluja.
4.2.5.2 Vaikutukset yleisön osallistumiseen
Läpinäkyvyysasetuksella haluttiin parantaa yleisön osallistumista ja tiedonsaantiasia, kun kyseessä ovat muuntogeenisten organismien tuotehyväksyntämenettelyt joko EU:n elintarvike- ja rehuasetuksen tai avoimen käytön direktiivin mukaisesti. Läpinäkyvyysasetukseen sisältyikin useita tiedon avoimuutta lisääviä muutoksia. Niihin kuuluvat avoimen käytön direktiiviin tehdyt tietojen luottamuksellisuuteen liittyvät muutokset, jotka on täytäntöönpantava geenitekniikkalailla. Joitakin mm. liikesalaisuuksiin, jalostusmenetelmiin ja henkilötietoihin liittyviä poikkeuksia lukuun ottamatta hakemuksiin sisältyvät tiedot olisivat julkisia. Henkilötietojen sekä yksityiselämän suojan kannalta on tärkeää, että tietoverkossa julkaistavissa asiakirjoissa julkaistaan ainoastaan tiedonsaannin kannalta välttämättömät henkilötiedot. Tiedot, jotka muodostavat osan asiaankuuluvan tiedekomitean tai asiaankuuluvien tiedekomiteoiden esittämien tieteellisten selvitysten päätelmiä tai arviointikertomusten päätelmiä ja jotka liittyvät ihmisten terveyteen, eläinten terveyteen tai ympäristöön kohdistuviin ennakoitavissa oleviin vaikutuksiin, olisi joka tapauksessa julkistettava.
Kenttäkokeita koskevan yleisön kuulemisajan lyhentäminen voi jossain määrin heikentää yleisön suoria osallistumismahdollisuuksia päätöksentekoon. On kuitenkin huomioitava, että yleisön kommentit voivat käytännössä vaikuttaa lupapäätöksen sisältöön vain, jos niistä ilmenisi, että kenttäkokeesta aiheutuisi sen riskinarvioinnista poiketen vaaraa ihmisen tai eläinten terveydelle tai ympäristölle. Nykyiset sähköiset viestintäkanavat myös tuovat kuulemismenettelyt entistä useamman ulottuville, joten ne voivat osaltaan merkittävästi nopeuttaa yleisön reagointimahdollisuuksia. Siten kuulemisajan lyhentämisen suorien tai epäsuorien vaikutusten ennakoidaan jäävän vähäisiksi, varsinkin kun yleisöltä kenttäkoehakemuksista saatujen kommenttien määrä on aiemmin ollut hyvin pieni. Kasveilla tehtyihin kenttäkokeisiin ovat yleisön kuulemisissa lähettäneet huomioita lähinnä erilaiset ympäristö- ja kuluttaja-asioita ajavat kansalaisjärjestöt, harvoin yksityishenkilöt.
Yleisön suhtautuminen muuntogeenisiin lääkkeisiin ja niiden tutkimukseen on yleensä ollut neutraalia tai positiivista verrattuna muuntogeenisiin kasveihin tai eläimiin. Rokotevastaisten kampanjoiden seurauksena kansalaiset saattaisivat tulevaisuudessa kiinnostua esittämään enemmän huomioita muuntogeenisiä organismeja sisältävillä rokotteilla ja lääkkeillä tehtävistä tutkimuksista. Kuulemisesta luopuminen on siten erityisen perusteltua tiettyihin lääketieteellisiin toimenpiteisiin, hoitoon tai tutkimuksiin osallistuvien henkilöiden terveyden tai yksityisyyden suojan turvaamiseksi, vaikka se rajoittaisi yleisön osallistumismahdollisuutta näissä tilanteissa.
4.2.5.3 Terveyteen kohdistuvat vaikutukset
Viimeaikaiset kokemukset muuntogeenisiä organismeja sisältävien erityisluvallisten lääkkeiden käytöstä kiireellisissä tilanteissa ja covid-19-pandemiassa saadut kokemukset rokotteiden ja lääkkeiden hyväksymismenettelyistä ovat saaneet useat EU:n jäsenvaltiot pyrkimään kansallisten hyväksymismenettelyiden tehostamiseen. Lyhyemmillä hakemusten käsittelyajoilla pystyttäisiin saavuttamaan terveyshyötyjä. Kenttäkokeiden tapauksessa hakemusmenettelyn kestoon voidaan kansallisesti vaikuttaa vain jäsenvaltion sisäisten viranomaismenettelyiden kuten yleisön kuulemisen osalta. Geenitekniikan lautakunta ei pysty myöntämään lupaa kenttäkokeelle nopeammin kuin 30 päivässä, koska hakemusmenettely aina edellyttää myös muiden EU:n jäsenvaltioiden kuulemista 30 päivän ajan. Yleisön kuulemisajan lyhentäminen nopeuttaisi kuitenkin hakemuksen käsittelyaikaa kiireellisissä tilanteissa, sillä em. kuulemiset voitaisiin toteuttaa samanaikaisesti. Tällöin kotimaasta yleisöltä saatuja kommentteja voitaisiin lautakunnassa jo huomioida päätöksen valmistelussa, vaikka muiden jäsenvaltioiden kommentteja hakemuksesta vielä odotettaisiin.
Esitetty 30 päivän kuulemisaika olisi ongelmallinen tilanteissa, joissa lääkehoidon nopea aloittaminen on tarpeen potilaan hengen pelastamiseksi tai vakavan sairauden estämiseksi. Tällainen tilanne on käsillä esimerkiksi, kun hoito erityisluvallisella valmisteella pitäisi toteuttaa erittäin nopeasti vauvaikäisen potilaan tietyssä kehitysvaiheessa, jotta se estäisi lapsen vaikean, invalidisoivan sairauden etenemisen. Esimerkkinä voidaan ajatella myös vakavaa epidemiatilannetta, jossa kliininen lääketutkimus rokotteen tai lääkkeen kehittämiseksi pitäisi saada käynnistettyä mahdollisimman nopeasti. Näissä tapauksissa kuulemisesta luopuminen olisi perusteltua potilaaseen kohdistuvien suorien terveyshyötyjen saavuttamiseksi. Hoitojen nopealla toteutumisella voisi joissakin tapauksissa olla myös epäsuoria yhteiskunnallisia vaikutuksia, jotka liittyvät esimerkiksi työkyvyn ylläpitämiseen tai pitkäaikaisten hoitokulujen vähenemiseen. Edellä mainituissa hoidoissa käytettävät valmisteet eivät tyypillisesti voi aiheuttaa haittaa ympäristölle, koska niiden sisältämät muuntogeeniset organismit ovat lisääntymiskyvyttömiä. Joissakin tapauksissa valmisteen käyttöön voi liittyä työsuojelukysymyksiä tai ainakin epäsuora teoreettinen tartuntariski potilaasta lähikontaktissa oleviin henkilöihin. Nämä mahdolliset epäsuorat vaikutukset huomioidaan aina valmisteen käyttöä koskevissa riskinhallintatoimenpiteissä, eikä esitys tässä suhteessa muuta väestön terveyteen kohdistuvia riskejä.
Nopeammat lupamenettelyt voisivat edesauttaa monikeskustutkimusten saamista Suomeen. Tämä on tärkeää esimerkiksi harvinaissairauksia koskevissa lääketutkimuksissa, joissa riittävän potilasmäärän kerääminen lääketutkimukseen edellyttää tutkimuksen toteuttamista useissa maissa. Lupamenettelyjen sujuvoittaminen parantaisi omalta osaltaan kaikkien suomalaisten potilaiden mahdollisuuksia päästä osallistumaan lääketutkimuksiin. Lääkevalmisteiden teho ja haittavaikutukset voivat vaihdella potilaan geneettisten ominaisuuksien perusteella ja suomalaisen väestön geeniperimä poikkeaa esim. eurooppalaisesta. Näin ollen suomalaisten potilaiden osallistuminen lääketutkimuksiin auttaisi osaltaan arvioimaan, onko tietystä muuntogeenisiä organismeja sisältävästä lääkevalmisteesta tai rokotteesta mahdollisesti hyötyä myös suomalaisille potilaille.
4.2.5.4 Vaikutukset potilastietojen suojaan
Lääkevalmisteen erityisluvallisessa käytössä on yleensä kyse joko yksittäisen potilaan tai pienen potilasmäärän hoitamisesta. Tällöin kenttäkokeista järjestettävään yleisön kuulemiseen voi liittyä merkittäviä yksityisyyden suojaa koskevia ongelmia, sillä kuulemisen yhteydessä julkistettavat tiedot voisivat mahdollistaa potilaan tunnistamisen sekä paljastaa hoidettavan arkaluontoisia henkilötietoja. Tämä riski koskee myös sellaisia kliinisiä lääketutkimuksia, joihin osallistuu pieniä, tarkoin rajattuja potilasryhmiä. Esitetty yleisön kuulemisesta luopuminen siis varmistaisi hoitoihin tai kokeisiin osallistuvien henkilöiden tietosuojan näissä tilanteissa.
Avoimen käytön direktiivin sisältöä on kuvattu edellä jaksossa 2.3. Monissa EU:n jäsenvaltioissa ei ole samanlaista viranomaisen hallussa olevien asiakirjojen avoimuuden periaatetta, jollainen Suomessa on ollut jo pitkään. Avoimen käytön direktiivin sääntely pohjautuu täten avoimuuden lisäämisen tarpeeseen viranomaistoiminnassa, eritoten niissä jäsenvaltioissa, joissa käsittelyn avoimuus ei ole pääsääntö kuten Suomessa.
Koska direktiivi on luonteeltaan harmonisoiva, siihen läpinäkyvyysasetuksen yhteydessä tehdyt muutokset on pantava täytäntöön kansalliseen lainsäädäntöön ilman kansallista liikkumavaraa. Sen sijaan kansallista liikkumavaraa on kenttäkokeiden yleisön kuulemisen määräajassa, josta ei ole direktiivillä säännelty. Tästä syystä asiasta voidaan säätää kansallisesti.
Avoimen käytön direktiivissä tarkoitettua kuulemisprosessia voidaan verrata EU:n elintarvike- ja rehuasetuksen mukaiseen kuulemisprosessiin, joka koskee muuntogeenisten organismien tuotehakemuksia. Siinä yleisöllä on EU:ssa 30 päivää aikaa huomioiden esittämiseen tuotehakemuksesta tehdystä arviointiraportista.
Yleisön kuulemisen järjestämisessä on EU:n tai ETA:n jäsenvaltioissa mahdollista käyttää kansallista harkintavaltaa. Yleisin kuulemisajan pituus EU:ssa on 30 päivää, sillä siihen ovat päätyneet Belgia, Tšekki, Unkari, Italia, Latvia, Puola, Portugali, Romania, Slovakia, Espanja ja Ruotsi. Avoimen käytön direktiivin mukaisessa kuulemisessa Itävallassa yleisöllä on kolme viikkoa aikaa esittää kirjallisia kommentteja. Jos kommentteja on esitetty, toimivaltaisella viranomaisella on kolme viikkoa aikaa järjestää julkinen kuuleminen. Itävallassa ei kuitenkaan järjestetä yleisön kuulemista, kun kyse on muuntogeenisillä organismeilla tehtävistä kliinisistä lääketutkimuksista, ja samaa periaatetta noudattaa seitsemän muuta jäsenvaltiota (Bulgaria, Kypros, Tanska, Viro, Saksa, Kreikka ja Liettua). Ranskassa ja Sloveniassa yleisön kuulemiseen kliinisistä lääketutkimuksista varataan 15−30 päivää ja Irlannissa 28 päivää. Norjassa yleisön kuulemiseen muuntogeenisten organismien tarkoituksellisesta levittämisestä on yleensä varattu kuusi viikkoa, mutta kliinisten lääketutkimusten osalta kuuleminen järjestetään tilanteen mukaan. Jos sellainen järjestetään, se saa kestää enintään 30 päivää. EU:n toiseksi pisin yleisön kuulemisaika muuntogeenisiä organismeja sisältävien lääkkeiden kliinisissä tutkimuksissa on Alankomaissa (kuusi viikkoa) ja pisin Suomessa (60 päivää).
Ympäristöministeriö kiinnittää lausunnossaan huomiota yleisön kuulemisajan lyhentämiseen kenttäkokeissa, ja pitää tavoitetta kuulemisajan lyhentämisestä perusteltuna. Ympäristöministeriö katsoo kuitenkin, että esityksessä olisi vielä tarkennettava kuulemista koskevan erityissääntelyn suhdetta julkisuuslainsäädäntöön ja siinä säädettyihin määräaikoihin. Sama koskee erillissääntelyllä säädettäväksi ehdotettua uutta geenitekniikan lautakunnalle annettavaa velvoitetta tehdä tarkoituksellista levittämistä ympäristöön koskevien hakemusten sisältämistä, toiminnanharjoittajan salassa pidettäviksi esittämistä tiedoista erillinen valituskelpoinen päätös ennen pääasian eli varsinaisen hakemusasian ratkaisemista. Suomen ympäristökeskus yhtyy lausunnossaan ympäristöministeriön lausuntoon.
Maa- ja metsätalousministeriö, työ- ja elinkeinoministeriö sekä opetus- ja kulttuuriministeriö esittivät lausuntonaan, ettei heillä ole huomautettavaa esitykseen.
Oikeusministeriö toteaa lausunnossaan, että ehdotettujen salassapitosäännösten, eritoten 32 a §:n suhdetta julkisuuslainsäädäntöön olisi tarkennettava esityksessä ja pyrittävä poistamaan salassapitosäännöksistä ristiriitaisuudet ja tulkintaepäselvyydet, vaikkakaan avoimen käytön direktiivi ei juuri anna kansallista liikkumavaraa. Myöskin luottamuksellisista tiedoista päättäminen ennen pääasian ratkaisua on kansallista lähtökohdista vieras. Esityksessä ei kuvata, miten tämä prosessi yhteensovittuisi muun asiakirjajulkisuussääntelyn ja siihen liittyvien menettelysäännösten kanssa tai millä perusteella kuvatun kaltaiseen ennakkopäätökseen perustuvan salassapidon ajallinen kesto määräytyisi. Esityksessä todetaan sääntelyn perustuvan täysharmonisoivaan direktiiviin. Esitettyjen muutosten suhdetta julkisuusperiaatteeseen ei ole tarkemmin kuvattu Suhde perustuslakiin ja säätämisjärjestys -osiossa, vaikkakin periaate sinällään on osiossa mainittu. Kenttäkokeiden yleisön kuulemisajan lyhentämistä koskevan säännöksen jatkovalmistelussa on huomioitava hallintolain (434/2003) vastikään uudistettu sääntely yleistiedoksiannosta ja julkisesta kuulutuksesta. Yleislaista poikkeamiselle tulee olla painavat, erityiset syyt. Kenttäkokeiden yleisön kuulemisen määräajan lyhentämistä on arvioiva erityisesti hallintolain 41 §:n näkökulmasta siten, että säädettävä määräaika olisi sillä tavoin riittävä, että sen puitteissa olisi tosiasialliset edellytykset käyttää säädettyä vaikuttamismahdollisuutta.
Valtiovarainministeriö sekä Tietosuojavaltuutetun toimisto ovat ilmoittaneet, etteivät anna esityksestä lausuntoa.
Geenitekniikan lautakunta toteaa lausunnossaan, että esityksellä muutettaisiin luottamuksellisten tietojen käsittelyä lautakunnassa, mikä pidentäisi jonkin verran hakemusten käsittelyaikoja. Näiden tietojen käsittelyn sekä salassa pidettävien tietojen uudelleen määrittelyn suhdetta julkisuuslainsäädäntöön tulisi selkeyttää esityksessä. Geenitekniikan lautakunta pitää tervetulleena yhtenäisten tiedostomuotojen käyttöön ottamista, sillä se helpottaa yhteistyötä muiden jäsenvaltioiden toimivaltaisten viranomaisten, komission ja EFSAn kanssa. Lautakunta pitää kuitenkin hieman erikoisena hakemusten toimittamista elintarvikkeille tarkoitettuun komission tietojärjestelmään, koska geenitekniikkalain mukaiset tuotehakemukset eivät voi koskea elintarvikkeita. Lautakunnan näkemyksen mukaan mainittu tietojärjestelmä ei todennäköisesti ole yhteensopiva geenitekniikan rekisterin tai Biosafety Clearing House-tietojärjestelmän kanssa. Tuotehakemusten sisällön ja lupamenettelyn käsittelyn uudistaminen lisäisivät jossain määrin lautakunnan työtä, mikä tulee huomioida lautakunnan tietojärjestelmien kehittämistyön resursoinnissa sekä henkilöstöresurssien mitoituksissa. Lautakunta katsoo, että hallituksen esitykseen tulisi kirjata velvoite seurata lautakunnan työmäärää. Yleisön kuulemista kenttäkoehakemuksista koskevien määräaikojen lyhentämiseen lautakunta suhtautuu myönteisesti. Kuulemisajan lyhentämisen jatkovalmistelussa on huomioitava kuulemista koskeva hallintolain uudistettu sääntely päällekkäisyyksien välttämiseksi.
Fimea esittää lain salassapitoa koskevan 32 ja 32 a §:n välistä keskinäistä suhdetta sekä näiden suhdetta julkisuuslainsäädäntöön selkeytettäväksi. Fimea korostaa lausunnossaan, että esitettyjen vakiotiedostomuotojen käyttöönoton yhteydessä geenitekniikan rekisterin ajantasaisuus ja yhteensopivuus tällaisten tiedostomuotojen kanssa tulee varmistaa rekisterin sujuvan toimimisen turvaamiseksi. Mikäli vakiotiedostomuotojen käyttöönotto edellyttää geenitekniikan rekisterin teknisten ominaisuuksien muuttamista, tulee tätä varten osoittaa riittävät resurssit, realistinen aikataulu ja rahoitus. Uudistuksen vaikutuksia geenitekniikan rekisterin käytön kannalta on esityksessä arvioitu ainoastaan geenitekniikan lautakunnan toiminnan näkökulmasta eikä Fimean roolia rekisterin ylläpitäjänä ole huomioitu. Yleisön kuulemisajan lyhentämistä on esityksessä perusteltu erityisesti kliinisiin lääketutkimuksiin ja muuntogeenisiä organismeja sisältävien lääkkeiden erityisluvalliseen käyttöön liittyvien lupaprosessien nopeuttamiseen liittyvillä seikoilla. Fimea pitää myönteisenä kliinisten lääketutkimusten toteuttamisedellytysten edistämistä Suomessa sekä erityisluvallisten muuntogeenisiä organismeja sisältävien lääkkeiden käytön helpottamista tilanteissa, joissa hoidon viivästyminen vaikuttaisi potilaan hoitoon peruuttamattomalla tavalla. Fimea pitää tärkeänä, että muuntogeenisten organismien tarkoituksellista levittämistä koskevien hakemusten asianmukaisesta käsittelystä varmistutaan jatkossakin eikä yleisön kuulemisen määräajan lyhentämisen tule vaikuttaa terveys- ja ympäristövaikutusten arviointiin heikentävästi geenitekniikan lautakunnassa. Fimean käsityksen mukaan esitetyt muutokset eivät kuitenkaan sinänsä vaikuttaisi riskinarvioinnin sisältöön lupaviranomaisessa, vaan hakemukset arvioitaisiin nykyisten lupamenettelyjen mukaisesti.
Ruokavirasto puoltaa esityksessä ehdotettua koskien vakioitua tiedostomuotoista hakemuksen jättämistä sekä luottamuksellisuutta ja luottamuksellisuuspyyntöjen käsittelyä. Asiakirjojen (hakemuksien, niiden tiivistelmien ja hakemuksiin kuuluvien asiakirjojen) yhtenäistäminen helpottaisi viranomaistyötä hakemusten arvioinnissa ja lausuntoja laadittaessa. Vakioitujen tiedostomuotojen toivotaan myös asettavan kaikki toimijat samalle linjalle hakemuksien muotoseikoissa, sekä olevan käyttäjäystävällisiä ja mukautettuja pienten ja keskisuurten yritysten käyttöön. Ruokavirasto pitää hyvänä läpinäkyvyysasetuksen mukaista EFSAn konsultaatiomahdollisuutta, mikä helpottaisi toiminnanharjoittajien sekä viranomaisten asemaa jo ennen hakemuksien jättämistä, erityisesti epäselvien tapauksien kohdalla. Ruokavirasto kannattaa myös kenttäkokeiden kuulemisaikojen lyhentämistä. Erityisesti Suomen lyhyen kasvukauden takia kenttäkoehakemusten nopeampi käsittely olisi tarkoituksenmukaista kotimaisten jalostusohjelmien ja tutkimushankkeiden kannalta. Kuulemisajan lyhentäminen 7 päivään, kun kyse on kiireellisestä lääkinnällisestä toimenpiteestä, jonka tarkoituksena on ihmisen hengen tai terveyden turvaaminen, on tarpeen.
Luonnonvarakeskus (Luke) katsoo lausunnossaan, että esityksellä ei ole vaikutuksia tuotehakemusten avoimuuteen ja läpinäkyvyyteen, jotka liittyvät ihmisten terveyteen, eläinten terveyteen tai ympäristöön kohdistuviin ennakoitavissa oleviin vaikutuksiin ja olisivat jatkossakin julkisia. Muuntogeenisillä organismeilla tehtävien kenttäkokeiden ehdotettu lyhennetty (30 vrk) kuulemisaika on Luonnonvarakeskuksen mielestä tarpeen, jotta geenitekniikkalain mukainen lupamenettely ei viivästyttäisi muuntogeenisillä organismeilla suoritettavien kliinisten lääketutkimusten tai niiden erityisluvallisen käytön aloittamista. Yleisön kuulemisajan lyhentäminen mahdollistaisi käsittelyaikojen nopeuttamisen kiireellisissä tilanteissa ja nopeamman kenttäkoehakemusten käsittelyn. Kuulemisajan lyhentämisen voidaan katsoa olevan positiivinen muutos, koska sillä ei ole vaikutusta kenttäkokeen toteuttamisen turvallisuuteen johtuen siitä, että riskinarviointiprosessiin ei tule muutoksia.
Helsingin yliopisto kannattaa (lääketieteellinen tiedekunta, farmasian tiedekunta ja bio- ja ympäristötieteen tiedekunta) kenttäkokeiden yleisön kuulemisaikojen lyhentämistä. Käsittelyaikojen nopeuttaminen lyhyempien kuulemisaikojen seurauksena parantaa kliinisen lääketutkimuksen ja muuntogeenisten organismien tutkimuksen toteuttamisedellytyksiä. Yliopiston eläinlääketieteellinen tiedekunta pitää myös esityksessä ehdotettuja muutoksia geenitekniikkalakiin tarkoituksenmukaisina ja puoltaa esitystä.
Lääketeollisuus ry kannattaa esitettyä muutosta yleisön kuulemisaikojen lyhentämisestä. Käsittelyaikojen nopeuttaminen parantaa kliinisen lääketutkimuksen ja muuntogeenisten organismien tutkimuksen toteuttamisedellytyksiä sekä mahdollistaa kiireelliset lääkinnälliset toimenpiteet, joiden tarkoituksena on ihmisen hengen tai terveyden turvaaminen.
Kuluttajaliitto – Konsumentförbundet ry ei kannata kenttäkokeiden yleisön kuulemisajan lyhentämistä 60 päivästä 30 päivään ja pitää kuulemisajan lyhentämistä heikennyksenä kansalaisten osallisuudelle. Sen sijaan poikkeusmahdollisuus lyhentää kuulemisaikaa 7 päivään ihmisen henkeen ja terveyteen liittyvien syiden vuoksi on hyväksyttävä ehdotus, jos kuulemisajan lyhentämisellä voidaan pelastaa ihmishenkiä. Kuluttajaliitto ry katsoo lausunnossaan, että näin lyhyt kuulemisaika on poikkeus, jota tulee tulkita suppeasti ja käyttää vain hyvin rajatuissa tilanteissa.
Suomen Luonnonsuojeluliitto ry katsoo lausunnossaan, että ehdotettu uusi lain 32 a § tuotehakemuksen salassa pidettävistä tiedoista heikentää kansalaisten tiedonsaantioikeutta sekä kenttäkokeiden kuulemisajan lyhentäminen kansalaisten osallistumismahdollisuutta, vaikkakin Liitto kannattaa ihmishengen pelastamiseksi kuulemisajan lyhentämistä 7 päivään. Kuulemista koskevien säännösten valmistelussa tulee huomioida hallintolain uudistetut säännökset. Internetissä kuulemista koskevien asiakirjojen julkaisemisen lisäksi lausuntomahdollisuudesta tulisi tehdä myös mediatiedote, ja siitä tulisi kertoa suoraan sidosryhmille, jotka voisivat ilmoittautua tiedonsaantilistalle.
Lausuntojen perusteella esityksen osioon Suhde perustuslakiin ja säätämisjärjestys- on lisätty uusi jakso 9.2 Julkisuusperiaate. Lisäksi jaksoa 9.3 Vastuu ympäristöstä ja osallistuminen sekä terveyden edistäminen on täydennetty sekä lisätty uusi jakso 9.4. Voimaanpanoasetukset.
Lain 32 a §:ää täsmennetty viittauksilla julkisuuslakiin. Samoin perusteluita on tarkennettu. Lain 36 b §:ää on täsmennetty poistamalla siitä hallintolain 62 §:n kanssa päällekkäinen sääntely.
Valtiontaloudellisten vaikutusten arviointia on täsmennetty siten, että geenitekniikan rekisteriä koskeva suunnitteilla oleva digitalisointityö liittyy esitykseen vain hyvin pieneltä osin, joten siitä aiheutuvia kustannuksia ei ole tässä vaiheessa mahdollista arvioida.
Esitykseen on lisätty uusi jakso 7 Seuranta, johon perustuen tehdään lain voimaantulon jälkeen komission vakiotiedostomuotojen valmistuttua jälkiarvio geenitekniikan lautakunnan resursseihin mahdollisesti tarvittavista resurssitarpeen lisäyksistä.
Lisäksi lausuntojen perusteella on tehty muita tarvittavia teknisiä tarkennuksia esitykseen. Lausuntokierroksen jälkeen jatkovalmistelussa on huomioitu esim. kenttäkokeena toteutettavien kliinisten lääketutkimusten ja erityisluvallisen hoidon vaikutukset toimenpiteiden, tutkimusten tai hoidon kohteena olevien henkilöiden yksityisyyden suojaan. Esimerkiksi harvinaisten sairauksien tutkimuksissa on vaarana se, että henkilön yksityisyyden suoja saattaa murtua, koska potilasmäärä on pieni, ja ongelma voi korostua, jos toimenpide, tutkimus tai hoito toteutetaan pienellä paikkakunnalla. Tästä syystä esitystä on muutettu siten, että tällaisissa henkilön yksityisyyden suojaa uhkaavista yleisön kuulemisista luovuttaisiin. Myös eräissä muissa jäsenmaissa kuulemisesta koskien kliinisiä lääketutkimuksia on luovuttu. Ehdotetut muutokset on saatettu geenitekniikan lautakunnalle tiedoksi lautakunnan 19.2.2021 pidetyssä kokouksessa.
Valtioneuvoston kanslian lainsäädännön arviointineuvosto antoi lausuntonsa esityksestä lausuntokierroksen jälkeen 9.3.2021. Neuvosto toteaa lausunnossaan, että esitysluonnoksessa kuvataan tiiviisti esityksen tausta, nykytila, perustelut, esityksen tavoite ja keskeiset ehdotukset. Lakiehdotusluonnoksen vaikutukset on kuvattu suppeasti. Arviointineuvosto esittää lausunnossaan, että vaikutusten kuvauksessa tulisi välttää teknisiä ja ammattikielen ilmauksia. Esitysluonnoksen vaikutusarvioita koskevaa osaa tulisi täsmentää kautta linjan. Käsittelyssä tulisi keskittyä esitysluonnoksessa ehdotettujen toimenpiteiden vaikutuksiin. Lisäksi tulisi selkeämmin erottaa toimenpiteiden suorat ja epäsuorat vaikutukset. Esitysluonnoksessa tulisi lisätä suuntaa-antavia määrällisiä kuvauksia muutoksen kohteena olevasta toiminnasta ja lakiesitysluonnoksen vaikutuksista.
Esitystä, eritoten sen vaikutusarviointeja, on tarkennettu lainsäädännön arviointineuvoston antaman lausunnon perusteella.
Esityksellä tuotehakemusten ja kenttäkokeiden lupamenettelyt muuttuvat raskaammiksi. Esitetyt muutokset lisäisivät geenitekniikan lautakunnan työmäärää, johon vaikuttavat paraikaa myös muuttunut toimintaympäristö ja tekninen kehitys. Nämä saattavat lähivuosina tuoda uudenlaisia organismeja ja vastuita geenitekniikkasääntelyn soveltamisalaan. Tämän vuoksi lupamenettelyiden käsittelyyn liittyvistä velvoitteista ei välttämättä selvittäisi nykyisillä lautakunnan sihteeristön ja ulkopuolisten esittelijöiden resursseilla, joihin kohdistuu lisääntyviä paineita mm. lääkekehityssektorilta. Tilannetta olisikin seurattava tarkasti, sillä muuntogeenisillä organismeilla suoritettavien kliinisten lääketutkimusten ja niitä sisältävien valmisteiden myyntilupahakemusten määrä on voimakkaassa kasvussa.
Lain jälkiseurannassa esitetään arvioitavaksi resurssien riittävyyttä tehtävien hoitamiseen. Lautakunnan työmäärän kehitystä ja sen edellyttämää muuta resurssitarvetta mm. geenitekniikkarekisterin kehittämistä varten olisi arvioitava viimeistään siinä vaiheessa, kun toimeenpanoasetus EU:n sähköisen tiedonhallintajärjestelmän käyttöön ottamisesta avoimen käytön hakemusten osalta annetaan. Arvioinnissa olisi otettava huomioon myös lautakunnalle aiheutuva työmäärä hakemusten sisältämien tietojen salassapidosta tehtävistä päätöksistä.
Ehdotetaan, että laki tulee voimaan mahdollisimman pian ottaen huomioon, että EU:n uutta läpinäkyvyysasetusta sovelletaan 27.3.2021 alkaen.
Lain 17 §:n 3 momentin sekä 20 §:n 3 momentin voimaansaattamisesta ehdotetaan kuitenkin annettavaksi erillinen voimaanpanoasetus. Toiminnanharjoittajan on kuitenkin toimitettava lain 20 §:n 3 momentissa tarkoitettu tuotehakemus Euroopan komission ylläpitämään tietojärjestelmään jo lain voimaantulosta lukien. Kenttäkoehakemuksen osalta ei ehdoteta säädettäväksi vastaavaa säännöstä hakemuksen toimittamisesta komission sähköiseen tietojärjestelmään ennen vakiotiedostomuotojen vahvistamista.
Jos kenttäkoetta tai tuotetta koskeva lupahakemus olisi pantu vireille ennen tämän lain voimaan tuloa, hakemuksen käsittelyssä noudatettaisiin kuitenkin tämän lain voimaan tullessa voimassa olleita säännöksiä.
Ehdotetun lain uuden 32 a §:n 4 momentin mukaan tietyt henkilötiedot ovat julkisia. Henkilötiedot voidaan 3 momentissa säädetyillä erityisillä ehdoilla pitää kuitenkin salaisina.
Perustuslain 10 §:n 1 momentin mukaan jokaisen yksityiselämä, ml. tietosuoja, on turvattu. Pykälän 1 momentin mukaan henkilötietojen suojasta säädetään tarkemmin lailla.
Perustuslakivaliokunta on painottanut, että yksityiselämän ja henkilötietojen suoja tulee suhteuttaa toisiin perus- ja ihmisoikeuksiin sekä muihin painaviin yhteiskunnallisiin intresseihin. Lainsäätäjän tulee turvata yksityiselämän ja henkilötietojen suoja tavalla, jota voidaan pitää hyväksyttävänä perusoikeusjärjestelmän kokonaisuudessa. Perustuslakivaliokunta on painottanut, että yksityiselämän ja henkilötietojen suojalla ei ole etusijaa muihin perusoikeuksiin nähden. Arvioinnissa on kyse kahden tai useamman perusoikeussäännöksen yhteensovittamisesta ja punninnasta (PeVL 54/2014 vp ja PeVL 10/2014 vp). Valiokunta on korostanut erityisesti asiakirjajulkisuuden ja henkilötietojen suojan välistä tasapainoa (PeVL 22/2008 vp).
Henkilötietojen suojaa koskevan kansallisen sääntelyn osalta on huomioitava EU:n tietosuoja-asetus. Tietosuoja-asetus on EU-asetuksena suoraan sovellettavaa oikeutta jäsenvaltioissa. Tietosuoja-asetuksessa on tunnistettu, että viranomaisten on voitava luovuttaa hallussaan olevien asiakirjojen sisältämiä henkilötietoja, mikäli tästä säädetään erikseen laissa. Lainsäädännössä on tällöin yhteensovitettava asiakirjojen julkisuus sekä oikeus henkilötietojen suojaan. Yleisessä tietosuoja-asetuksessa vahvistetaan henkilötietojen suojaa koskevat yleiset periaatteet, esimerkiksi tietojen minimoinnin periaate henkilötietojen käsittelyn tarkoitukseen nähden, joita tulisi mahdollisimman tehokkaasti toteuttaa myös asiakirjajulkisuuden ja henkilötietojen suojan yhteensovittavassa lainsäädännössä.
Suomessa tietosuojalailla on täydennetty ja täsmennetty tietosuoja-asetusta. Tietosuojalaki on henkilötietojen käsittelyä koskeva yleislaki. Julkisuuslaki sisältää salassapitoa koskevat yleissäännökset. Julkisuuslain 24 §:ssä säädetään salassa pidettävistä viranomaisen asiakirjoista.
Henkilötietojen sekä yksityiselämän suojan kannalta on tärkeää, että tietoverkossa julkaistavissa asiakirjoissa julkaistaan ainoastaan tiedonsaannin kannalta välttämättömät henkilötiedot (PeVL 63/2014 vp). Välttämättöminä henkilötietoina voitaisiin pitää kenttäkokeiden yleisökuulemisessa toiminnanharjoittajan nimeä sekä kenttäkokeen sijaintipaikkaa, jos sijaintipaikka on myös toiminnanharjoittajana toimivan luonnollisen henkilön asuinpaikka. Kuulutuksessa ja kuulutettavissa asiakirjoissa on tarpeen ilmoittaa nämä tiedot, jotta asia tulisi riittävästi yksilöidyksi, ja jotta asianosaiset ja yleisö voisivat arvioida toiminnan ympäristövaikutuksia sen sijaintipaikan ympäristöön. Kyseiset tiedot ilmenevät muuntogeenisten organismien tarkoituksellista levittämistä koskevien hakemusten tiivistelmistä, jotka julkaistaan kuulemisen yhteydessä.
Henkilötietojen käsittelyn tulee olla asiallisesti perusteltua viranomaisen toiminnan kannalta. Ilman asianomaisen henkilön suostumusta henkilötietoja saa käsitellä vain, jos käsittelystä säädetään laissa tai käsittely johtuu rekisterinpitäjälle laissa säädetystä tai sen nojalla määrätystä tehtävästä tai velvoitteesta. Kaiken henkilötietojen käsittelyn on myös oltava oikeutettua ja tarpeellista koko sen ajan, jolloin tietoja käsitellään.
Julkisuuslain 16 §:n 3 momentissa säädetään viranomaisen henkilörekisterin henkilötietoja sisältävän tiedon luovuttamistavasta ja luovuttamisen edellytyksistä. Säännöksen mukaan tiedon saa luovuttaa sähköisessä muodossa, jos luovutuksensaajalla on henkilötietojen suojaa koskevien säännösten mukaan oikeus tallettaa ja käyttää sellaisia henkilötietoja. Kun tieto luovutetaan yleisen tietoverkon kautta, viranomainen ei voi varmistua luovutuksensaajan oikeudesta henkilötiedon käyttämiseen, koska tieto on kenen tahansa yleisen tietoverkon käyttäjän saatavissa. Jotta kuulutus ja kuulutettavat asiakirjat (kuten hakemusasiakirjat) voisivat sisältää tiedottamisen kannalta olennaisen tiedon, on säännös julkisuuslain 16 §:n 3 momentista poikkeamiseksi tarpeen. Kenttäkokeiden yleisön kuulemista varten tietoverkossa julkaistavat asiakirjat, kuulutus ja kuulutettava asiakirja sisältävät henkilötietoja, ja ne ovat osa geenitekniikkalain 26 §:ssä tarkoitettuun geenitekniikan rekisteriin sisältyviä tietoja. Tällöin kyse on julkisuuslain 16 §:n 3 momentin tarkoittamista tilanteista. Ilman julkisuuslain 16 §:n 3 momentista poikkeavaa säännöstä yleisessä tietoverkossa ei ole mahdollista julkaista sellaista tietoa, joka kuuluu henkilörekisteriin.
Henkilötietojen sekä yksityiselämän suojan kannalta on tärkeää, että tietoverkossa julkaistavissa asiakirjoissa julkaistaan ainoastaan tiedonsaannin kannalta välttämättömät henkilötiedot (PeVL 63/2014 vp). Vaikka toiminnan sijaintipaikkatieto voi jossain yksittäisessä tilanteessa käytännössä olla myös luonnollista henkilöä koskeva tunnistetieto, on tällaisen tiedon ilmoittaminen kuulemisessa kuitenkin tarpeen. Toiminnan sijaintipaikkatiedon sisältävän hakemuksen tiivistelmän sekä lupapäätöksen on tarpeen olla yleisesti saatavilla myös lupapäätöksen nähtävilläpitoajan jälkeen päätöksen tultua lainvoimaiseksi. Yleisöllä ja asianosaisilla on oltava tieto toiminnasta ja sen sijainnista, jotta kenttäkokeen lupapäätöksen sisältöä ja toiminnan ympäristövaikutuksia voidaan arvioida myös toiminnan aloittamisen jälkeen. Geenitekniikan lautakunta julkaisee mainitut kenttäkokeita koskevat tiedot verkkosivuillaan osoitteessa https://geenitekniikanlautakunta.fi/etusivu.
Perustuslakivaliokunta on ottanut kantaa lausunnossaan (PeVL 14/2018 vp) siihen, ettei erityislainsäädäntöön ole tietosuoja-asetuksen soveltamisalalla enää valtiosääntöisistä syistä välttämätöntä sisällyttää kattavaa ja yksityiskohtaista sääntelyä henkilötietojen käsittelystä, koska nykyinen henkilötietojen sääntelymalli on koettu varsin raskaaksi ja monimutkaiseksi. Perustuslakivaliokunnan mielestä tietosuoja-asetuksen yksityiskohtainen sääntely, jota tulkitaan ja sovelletaan EU:n perusoikeuskirjassa turvattujen oikeuksien mukaisesti, muodostaa yleensä riittävän säädöspohjan myös perustuslain 10 §:ssä turvatun yksityiselämän ja henkilötietojen suojan kannalta. Valiokunnan näkemyksen mukaan henkilötietojen suoja tulee jatkossa turvata ensisijaisesti yleisen tietosuoja-asetuksen ja säädettävän kansallisen yleislainsäädännön nojalla. Esityksessä henkilötietojen suojasta ehdotetaan säädettäväksi lain uudessa 32 a §:ssä ottaen huomioon avoimen käytön direktiivin vaatimukset tietojen käsittelylle silloin, kun ne liittyvät hakemuksen tueksi toimitettavien tieteellisiin selvityksiin, selkärankaisilla eläimillä suoritettaviin testauksiin tai toksikologisten tietojen hankkimiseen osallistuneiden henkilöiden tietojen julkaisemiseen. Lisäksi ehdotetaan lain 36 b §:ssä luovuttavaksi yleisön kuulemisesta, jos tarkoituksellisesta levittämisestä muussa kuin markkinoillesaattamistarkoituksessa järjestettävässä yleisön kuulemisessa julkaistavat tiedot voisivat paljastaa arkaluontoisia henkilötietoja.
Perustuslain 12 §:n 2 momentin mukaan viranomaisen hallussa olevat asiakirjat ja muut tallenteet ovat julkisia, jollei niiden julkisuutta ole välttämättömien syiden vuoksi lailla erikseen rajoitettu. Jokaisella on oikeus saada tieto julkisesta asiakirjasta ja tallenteesta.
Kansallinen julkisuus- ja salassapitosääntely perustuu perustuslain 12 §:n 2 momentista johtuvista syistä asiakirjojen julkisuuden lähtökohdalle. Asiakirjan julkisuutta voidaan rajoittaa vain välttämättömien syiden vuoksi erikseen lailla. Salassapitoperusteista säädetään pääsäännön mukaan keskitetysti viranomaisten julkisuuslaissa. Julkisuuslain mukaan julkisuuden rajoituksia arvioidaan ja päätös asiakirjan tai siinä olevan tiedon salassapidosta tehdään siinä vaiheessa, kun tällaista tietoa tai asiakirjaa pyydetään viranomaiselta. Muu olisi usein myös käytännössä mahdotonta, erityisesti jos salassapito perustuu vahinkoedellytykseen, jonka toteaminen vaatii tapauskohtaista arviointia. Salassapito voi myös lakata ajan kulumisen, olosuhteiden muuttumisen tai laissa säädetyn syyn perusteella, jolloin päätösten tekeminen sitovasti etukäteen olisi julkisuusperiaatteen asianmukaisen toteutumisen kannalta ongelmallista. Tietojen salassapito ei myöskään eräitä erityistilanteita lukuun ottamatta (esim. julkisuuslain 24 § 1 mom. 31 kohta) ole riippuvainen asianosaisen esittämästä pyynnöstä, eikä myöskään pyyntö pitää asiakirja salassa ole viranomaista sitova, sillä salassapito määräytyy viranomaisen lakiin sidotun objektiivisen arvion perusteella (ks. myös PeVL 50/2010 vp). Perustuslakivaliokunta on painottanut, että hallituksen esityksessä on erityisesti perusoikeuksien kannalta merkityksellisen sääntelyn osalta syytä tehdä selkoa kansallisen liikkumavaran alasta (ks. esim. PeVL 1/2018 vp, s. 3, PeVL 26/2017 vp, s. 42). Perustuslakivaliokunta on korostanut, että siltä osin kuin Euroopan unionin lainsäädäntö edellyttää kansallista sääntelyä tai mahdollistaa sen, tätä kansallista liikkumavaraa käytettäessä otetaan huomioon perus- ja ihmisoikeuksista seuraavat vaatimukset (ks. esim. PeVL 12/2019 vp, PeVL 9/2019 vp, PeVL 6/2019 vp ja PeVL 25/2005 vp).
Lain 32 §:ään, jossa säädetään tietojen julkisuudesta ja salassapidosta, ehdotetaan tehtäväksi teknisiä täsmennyksiä. Ehdotettu uusi 32 a § koskee tarkoituksellista levittämistä ympäristöön koskevien hakemusten salassapitoa. Ehdotettu uusi 32 a § on erillissääntelyä suhteessa lain 32 §:ään. Kansallinen julkisuuslainsäädäntö ja EU-lainsäädäntö, joka täytäntöön pannaan mainituilla säännöksillä, ovat keskenään loogisessa sekä normatiivisessa ristiriidassa sen suhteen, miten tietojen julkisuudesta tai salassapidosta säädetään. Julkisuuslain mukaan kaikki, mitä ei erikseen säädetä salassa pidettäväksi, on julkista. Sen sijaan avoimen käytön direktiivin sääntely perustuu luetteloihin joko julkisista tiedoista tai vastaavasti salassa pidettävistä tiedoista.
Tietyissä oikeushyvien kollisiotilanteissa perustuslain 19 §:n 3 momentissa tarkoitetulla väestön terveyden edistämisellä sekä 20 §:n 2 momentissa tarkoitetulla ympäristövastuulla voidaan esim. suojalausekkeen käytön edellyttämässä laajuudessa katsoa olevan etusija suhteessa liikesalaisuuksien suojaan. Tällöin viranomaisen hallussa olevien po. asiakirjojen julkisuutta ei enää voitaisi rajoittaa perustuslain 12 §:n 2 momentissa tarkoitetuilla välttämättömillä syillä. Esim. lain 32 a §:n 6 momentin mukaan geenitekniikan lautakunta voisi julkaista 1 momentissa tarkoitetut tiedot, jos kiireelliset toimet ovat välttämättömiä ihmisten terveyden, eläinten terveyden tai ympäristön suojelemiseksi.
Perustuslain 20 §:n 1 momentin mukaan vastuu luonnosta ja sen monimuotoisuudesta, ympäristöstä ja kulttuuriperinnöstä kuuluu kaikille. Säännöksen mukainen vastuu ympäristöstä toteutuu aineellisen lainsäädännön kautta. Säännöksen piiriin kuuluvat sekä ympäristön tuhoutumisen tai pilaantumisen estäminen että aktiiviset luonnolle suotuisat toimet. Perustuslain 20 §:n 2 momentin mukaan julkisen vallan on pyrittävä turvaamaan jokaiselle oikeus terveelliseen ympäristöön sekä mahdollisuus vaikuttaa elinympäristöään koskevaan päätöksentekoon.
Esityksen 36 b §:ään sisältyvällä yleisön kuulemista koskevan määräajan pituuden lyhentämisellä 60 päivästä 30 päivään on merkitystä arvioitaessa 20 §:n 2 momentissa säädettyä velvoitetta turvata kansalaisten vaikutusmahdollisuudet elinympäristöään koskevaan päätöksentekoon. Perustuslain 19 §:n 3 momentin mukaan julkisella vallalla on puolestaan velvollisuus edistää väestön terveyttä.
Geenitekniikan lautakunnan järjestämistä yleisön kuulemisista on lähtökohtaisesti tarkoitus ilmoittaa esim. twitterissä. Täten asiasta kiinnostuneet tahot saisivat reaaliajassa tiedon lautakunnan www-sivuilla julkaistusta kuulemisesta ja ehtisivät siihen reagoida annetussa ajassa.
Kun lääkevalmisteen kliinisellä käytöllä voidaan edistää potilaan terveyttä tai jopa pelastaa ihmishenki, on eettisesti perusteltua pyrkiä lyhentämään viranomaismenettelyiden määräaikaa. Jos on kyse lääkinnällisestä toimenpiteestä, tutkimuksesta tai hoidosta, jonka tarkoituksena on ihmisen hengen tai terveyden turvaaminen tai on vaarana, että kokeen kohteena olevien henkilöiden yksityisyyden suojaa ei voida muulla tavoin turvata, on välttämätöntä luopua yleisön kuulemisesta kokonaan. Esim. harvinaissairauksien osalta Suomessa potilaina on sangen suppea henkilöryhmä, joka voisi olla tunnistettavissa yleisökuulemisessa annetuilla tiedoilla. Vaikka kuulemisesta luopuminen heikentääkin yleisön vaikuttamismahdollisuuksia, on perustuslain 10 §:n tarkoitettu yksityiselämän suoja, ml. arkaluontoisten henkilötietojen, kuten terveystietojen suoja, sekä perustuslain 19 §:n 3 momentissa tarkoitettu terveyden edistäminen tärkeämpi oikeushyvä kuin perustuslain 20 §:n 2 momentissa tarkoitettu kansalaisten vaikutusmahdollisuus elinympäristöään koskevaan päätöksentekoon.
Lain 17 §:n 3 momentin sekä 20 §:n 3 momentin voimaantulosta säädettäisiin erikseen valtioneuvoston voimaanpanoasetuksella lain ehdotetun siirtymäsäännöksen mukaan. Perustuslain 79 §:n 3 momentin mukaan laista tulee käydä ilmi, milloin se tulee voimaan. Erityisestä syystä laissa voidaan säätää, että sen voimaantuloajankohdasta säädetään asetuksella. Perustuslakivaliokunnan käytännössä on katsottu, että tällaisena erityisenä syynä voi olla se, että lainsäädäntö on sidoksissa Euroopan yhteisön oikeuteen (ks. esim. PeVL 5/2009 vp, PeVL 21/2007 vp, PeVL 46/2006 vp). Pykälien voimaantulo olisi sidoksissa siihen, milloin komissio tekee ilmoituksen siitä, että tuote- ja kenttäkoehakemuksia koskevat vakiotiedostomuodot ovat valmistuneet. Tähän saattaa mennä useita vuosiakin. Näin ollen esillä on perustuslain 79 §:n 3 momentin mukainen erityinen syy, jonka perusteella lain voimaantulosta voidaan säätää asetuksella.
Edellä sanotusta johtuen esitys katsotaan voitavan käsitellä tavallisen lain säätämisjärjestyksessä.
Ponsi
Edellä esitetyn perusteella annetaan eduskunnan hyväksyttäväksi seuraava lakiehdotus:
Eduskunnan päätöksen mukaisesti
muutetaan geenitekniikkalain (377/1995) 20 §:n 3 momentti, 32 ja 36 b §, sellaisina kuin ne ovat, 20 §:n 3 momentti ja 32 ja 36 b § laissa 847/2004, sekä
lisätään 17 §:ään, sellaisena kuin se on laissa 847/2004, uusi 3 momentti, jolloin nykyinen 3 momentti siirtyy 4 momentiksi, ja lakiin uusi 32 a § seuraavasti:
17 §Hakemus
Hakemus on toimitettava elintarvikelainsäädäntöä koskevista yleisistä periaatteista ja vaatimuksista, Euroopan elintarviketurvallisuusviranomaisen perustamisesta sekä elintarvikkeiden turvallisuuteen liittyvistä menettelyistä annetun Euroopan parlamentin ja neuvoston asetuksen (EY) N:o 178/2002, jäljempänä yleinen elintarvikeasetus, 39 f artiklan nojalla hyväksytyn vakiotiedostomuodon mukaisesti.
20 §
Lupamenettely
Riskien arvioimiseksi sekä terveys- ja ympäristövaikutusten tunnistamiseksi hakemuksen tulee sisältää avoimen käytön direktiivin 13 artiklan 2 kohdassa tarkoitetut tiedot. Hakemus on toimitettava yleisen elintarvikeasetuksen 39 f artiklan nojalla hyväksytyn vakiotiedostomuodon mukaisesti Euroopan komission ylläpitämän tietojärjestelmän kautta. Geenitekniikan lautakunnan on tutkittava viipymättä, onko hakemus laadittu tämän lain mukaisesti ja pyydettävä tarvittaessa toiminnanharjoittajalta lisätietoja.
32 §
Tietojen julkisuus ja salassapito
Salassa pidettävinä tietoina ei pidetä:
1) asiakirjan päivämäärää;
2) toiminnanharjoittajan nimeä ja osoitetta;
3) muuntogeenisten organismien yleistä kuvausta;
4) muuntogeenisten organismien käytön paikkaa, tarkoitusta, laajuutta sekä suunniteltua käyttöä ja seurantaa koskevia tietoja;
5) suljetun käytön luokkaa ja eristämistoimenpiteitä;
6) hätätilanteita varten tarkoitettuja menetelmiä ja suunnitelmia;
7) riskinarviointia;
8) tämän lain mukaisia lupa-asiakirjoja.
Toiminnanharjoittajan tulee yksilöidä ne tiedot, joita se pitää salassa pidettävinä. Toiminnanharjoittajan on perusteltava käsityksensä. Tietoja luovutettaessa geenitekniikan lautakunta päättää toiminnanharjoittajaa kuultuaan, mitä tietoja tulee pitää salassa.
Tässä laissa säädettyjä tehtäviä hoidettaessa saatujen ja laadittujen asiakirjojen julkisuuteen ja salassapitoon sovelletaan muutoin, mitä viranomaisten toiminnan julkisuudesta annetussa laissa (621/1999) säädetään, jollei tässä laissa toisin säädetä.
32 a §Tarkoituksellista levittämistä ympäristöön koskevien hakemusten salassapito
Poiketen siitä, mitä viranomaisten toiminnan julkisuudesta annetun lain 24 §:n 1 momentin 20 kohdassa säädetään liikesalaisuudesta, geenitekniikan lautakunta voi toiminnanharjoittajan pyynnöstä vahvistaa tämän lain 17 ja 20 §:ssä tarkoitetuista hakemuksista salassa pidettäviksi seuraavat tiedot:
1) valmistus- ja tuotantoprosessi, mukaan luettuna menetelmä ja sen innovatiiviset näkökohdat sekä muut tekniset ja teolliset eritelmät, jotka kuuluvat olennaisena osana mainittuun prosessiin tai menetelmään, lukuun ottamatta turvallisuuden arvioinnin kannalta olennaisia tietoja;
2) tuottajan tai maahantuojan kaupalliset yhteydet toiminnanharjoittajaan tai luvan haltijaan;
3) kaupalliset tiedot, joista käyvät ilmi toiminnanharjoittajan hankintalähteet, markkinaosuudet tai liiketoimintastrategia;
4) DNA-sekvenssiä koskevat tiedot, lukuun ottamatta muunnostapahtuman havaitsemis-, tunnistamis- ja kvantifiointimenetelmissä käytettyjä sekvenssejä;
5) jalostusmallit ja -strategiat.
Edellytyksenä 1 momentissa tarkoitetulle salassapidolle on, että toiminnanharjoittaja voi osoittaa tietojen paljastamisen voivan vahingoittaa merkittävästi sen etuja.
Lisäksi tieteellisissä selvityksissä salassa voidaan pitää luonnollisten henkilöiden yksityisyyden ja koskemattomuuden suojelemiseksi sellaisten luonnollisten henkilöiden nimiä ja osoitteita, jotka osallistuvat selkärankaisilla eläimillä tehtyyn testaukseen tai toksikologisten tietojen hankkimiseen, ellei muualla toisin säädetä.
Edellä 1 ja 3 momentissa tarkoitettu geenitekniikan lautakunnan päätös on tehtävä ennen 36 b §:n mukaista yleisön kuulemista, ja siitä on ilmoitettava toiminnanharjoittajalle.
Sen estämättä, mitä 3 momentissa säädetään, tämän lain 17 ja 20 §:ssä tarkoitetuissa hakemusmenettelyissä noudatetaan viranomaisten toiminnan julkisuudesta annetun lain 24 §:n 1 momentin 31 kohtaa, kuitenkin siten, että näihin liittyvissä tieteellisissä selvityksissä salassa pidettävinä henkilötietoina ei pidetä seuraavia tietoja:
1) toiminnanharjoittajan nimi ja osoite;
2) pyyntöä tukevien julkaistujen tai julkisesti saatavilla olevien tutkimusten tekijöiden nimet;
3) selvityksiin osallistuneiden tieteellisten komiteoiden ja paneelien, niiden työryhmien ja muiden asiaa käsittelevien ad hoc -työryhmien kokouksiin osallistuneiden ja niissä tarkkailijoina toimineiden nimet.
Poiketen siitä, mitä 1 momentissa säädetään, geenitekniikan lautakunta voi julkaista 1 momentissa tarkoitetut tiedot, jos se on välttämätöntä ihmisten terveyden, eläinten terveyden tai ympäristön suojelemiseksi. Tiedot, jotka muodostavat osan tiedekomitean esittämien tieteellisten selvitysten päätelmiä tai arviointikertomusten päätelmiä ja jotka liittyvät ihmisten terveyteen, eläinten terveyteen tai ympäristöön kohdistuviin ennakoitavissa oleviin vaikutuksiin, on joka tapauksessa julkistettava.
Sen lisäksi, mitä viranomaisten toiminnan julkisuudesta annetussa laissa säädetään, geenitekniikan lautakunnan on säilytettävä tietojen luottamuksellisuus riippumatta siitä, onko toiminnanharjoittajan luottamuksellisuuspyyntöä ehditty käsitellä, jos toiminnanharjoittaja peruuttaa ilmoituksen tai hakemuksen, johon sisältyviä tietoja se on pyytänyt käsiteltävän luottamuksellisina.
36 b §Tarkoituksellista levittämistä ympäristöön muussa kuin markkinoillesaattamistarkoituksessa koskeva yleisön kuuleminen
Geenitekniikan lautakunnan on kuultava yleisöä suunnitellusta tarkoituksellisesta levittämisestä muussa kuin markkinoillesaattamistarkoituksessa noudattaen, mitä hallintolain (434/2003) 62 a ja 62 b §:ssä säädetään julkisesta kuulutuksesta, jollei tässä laissa toisin säädetä.
Kuulemisaika on 30 päivää. Kuuleminen voidaan kuitenkin jättää toteuttamatta, jos on kyse kiireellisestä lääkinnällisestä toimenpiteestä, tutkimuksesta tai hoidosta, jonka tarkoituksena on ihmisen hengen tai terveyden turvaaminen tai jos kuuleminen on omiaan vaarantamaan toimenpiteen kohteena olevan henkilön yksityisyyden suojan.
Salassapitovelvollisuudesta säädetään 32 ja 32 a §:ssä.
Tämä laki tulee voimaan päivänä kuuta 20 .
Lain 17 §:n 3 momentti ja 20 §:n 3 momentti tulevat kuitenkin voimaan valtioneuvoston asetuksella säädettävänä ajankohtana.
Toiminnanharjoittajan on kuitenkin toimitettava 20 §:n 3 momentissa tarkoitettu hakemus Euroopan komission ylläpitämään tietojärjestelmään jo lain voimaantulosta lukien.
Ennen lain voimaan tuloa vireille tullut tämän lain voimaan tullessa voimassa olleessa 17 §:n 1 momentissa tarkoitettu lupahakemus muuntogeenisten organismien tai niiden yhdistelmän tarkoituksellisen levittämisen aloittamiselle Suomen valtion alueella sekä vastaavasti 20 §:n 1 momentissa tarkoitettu lupahakemus saattaa tuotteina tai tuotteissa oleva muuntogeeninen organismi tai organismien yhdistelmä Suomessa markkinoille käsitellään kuitenkin tämän lain voimaan tullessa voimassa olleiden säännösten mukaan.
Helsingissä 8.4.2021
Pääministeri
Sanna Marin
Perhe- ja peruspalveluministeri
Krista Kiuru
